已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力。比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc。下列关于酸性强弱的说法正确的是( )
| A.在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B.比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C.HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D.比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
在某无色透明的酸性溶液中,能共存的离子组是
| A.Na+ 、K+、SO42-、HCO3- | B.Cu2+、K+、SO42-、NO3- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、Cl- |
下列变化中需加入氧化剂才能实现的是
| A.Fe3+→Fe2+ | B.Cl-→Cl2 | C.CuO→Cu | D.H2SO4→BaSO4 |
下列电离方程式错误的是
| A. NaHCO3 =Na+ +H+ +CO32― | B. NaHSO4=Na+ +H+ +SO42― |
| C. MgCl2=Mg2+ +2Cl― | D.Ba(OH)2 =Ba2+ +2OH― |
下列状态的物质,既能导电又属于电解质的是
| A.氯化镁晶体 | B.氯化钠溶液 |
| C.液态氯化氢 | D.熔融氢氧化钾 |
在标准状况下,如果5.6L氧气含有2n个氧原子,则阿伏加德罗常数可表示为
A.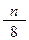 |
B.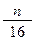 |
C.8n | D.4n |