向10.4g Fe3O4、Fe2O3、Cu的混合物中加入1 mol·L−1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
| A.1.12g | B.2.24g | C.3.24g | D.6.42g |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
25℃,101kPa时,使1.0 g钠与足量氯气反应,生成氯化钠晶体并放出17.87kJ的热量,生成1 mo NaCl的反应热为
| A.17.87kJ | B.—17.87kJ/mol | C.411 kJ/mol | D.—411 kJ/mol |
下列说法中正确的是
| A.原电池是把电能转化为化学能的装置 |
| B.原电池中电子流入的一极是正极,发生还原反应 |
| C.铜锌原电池中电子由锌电极经过溶液到铜电极 |
| D.原电池中的阳离子向负极移动 |
已知某可逆反应:2M(g) N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是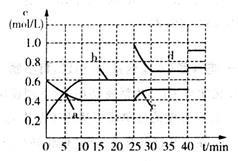
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N |
| C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 |
| D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
在密闭容器中进行反应:X2(g)+Y2(g) 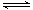 2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Y2为0.15mol/L | B.Z为0.2mol/L |
| C.X2为0.3mol/L | D.Z为0.4mol/L |