(14分) 碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
(2)又知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
①其他条件不变,降低温度,反应达到新平衡前v(逆)______v(正)(填“>”、“<”、“=”)
②该温度下此反应的平衡常数K=___________
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
某实验小组进行了如下图所示的实验。下列说法不正确的是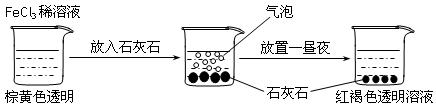
| A.红褐色液体为氢氧化铁胶体 | B.加入石灰石是为了促进氯化铁水解 |
| C.产生的气泡是HCl 气体 | D.产生的气泡是CO2气体 |
给CH3COOH、C2H5 OH和浓硫酸的混合物加热,一段时间后,18O存在于
OH和浓硫酸的混合物加热,一段时间后,18O存在于
| A.只存在乙酸分子中 | B.存在于乙酸乙酯、乙醇中 |
| C.只存在于乙醇分子中 | D.只存在于水分子中 |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
| A.植物油不能使溴水褪色 | B.淀粉水解的最终产物是葡萄糖 |
| C.葡萄糖、蔗糖都能水解 | D.蛋白质溶液中滴加硝酸汞溶液后可发生盐析 |
当乙醇分子中的氧原子被硫原子代替后即为乙硫醇(C2H5SH),乙硫醇的沸点为36.2℃,而乙醇(C2H5OH)的沸点为78.4℃。以下能对两者沸点差异作正确解释的是
| A.相对分子质量的大小 | B.共价键的强弱 | C.氢键 | D.结构的相似性 |
已知C5H11Br有8种同分异构体,则C6H12O2属于羧酸的结构有
| A.4种 | B.8种 | C.16种 | D.6种 |