下列图示实验现象及其解释不正确的是( )
| A.图A,一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
| B.图B,加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
| C.图C,溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
| D.图D,加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
FeSO4和Fe2(SO4)3的混合物中含硫的质量分数为a%,则含铁的质量分数为( ).
| A.2a% | B.3a% | C.1-2a% | D.1-3a% |
将3.9g镁铝合金,投入到500mL2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( ).
).
| A.125mL | B.200mL | C.250mL | D.560mL |
下列冶炼金属的原理正确的是( ).
A.2Al2O3+3C 4Al+3CO2↑ 4Al+3CO2↑ |
B.Fe2O3+4CO 3Fe+4CO2 3Fe+4CO2 |
C.MgO+H2  Mg+H2O Mg+H2O |
D.2HgO 2Hg+O2↑ 2Hg+O2↑ |
氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。根据题意完成第27~30题:
27.在上述变化过程中,发生还原反应的过程是:___________→___________(填化学式)。
28.该反应的氧化产物是______________(填化学式);所得混合气体的平均式量为_______。
29.已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,有关离子反应方程式为:
。
30.在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1升,测得溶液的pH = 2,则在反应中转移电子的物质的量为mol。
已知丙氨酸的结构简式为: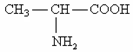 ,根据题意完成第23~26题:
,根据题意完成第23~26题:
23.丙氨酸中涉及到四种元素,它们的原子半径由小到大的顺序为。
24.丙氨酸分子属于(填“极性”或“非极性”)分子,一个丙氨酸分子中含有
个非极性共价键。
25.丙氨酸分子中的氮原子核外有个未成对电子,有种不同能量的电子。
26.碳、氮、氧都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2,碳元素的氢化物除CH4外,还有C2H6等。与之相似的氮元素的氢化物的除NH3外,还有________,该氢化物与足量盐酸反应的化学方程式为______________________。