(18分)铁及其他合物在工业生产中有着广泛的应用。请按要求回答下列问题:
I.工业上利用硫酸铁矿烧渣(主要成分为Fe2O3、Al2O3、SiO2等)为原料提取Fe2O3,工艺流程如下图1: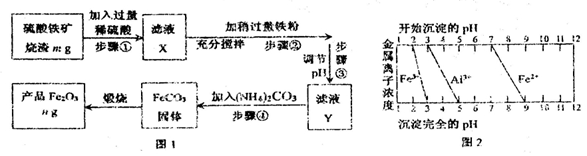
(1)滤液X中所含金属阳离子有 。
(2)步骤②中理论上发生反应的离子方程式依次为 。
(3)结合图2,分析步骤③调节pH的目的是 。
(4)假设流程中矿渣中的铁元素100%转化到产品中,则硫酸铁矿烧渣样品中Fe2O3的质量分数范围为(含m、n的代数式) 。
(5)请设计实验室中以硫酸铁矿烧渣为原料提取氧化铁的另一种方案:向硫酸铁矿烧渣原料中加入过量稀硫酸、充分搅拌、过滤,再向滤液中加入足量的 溶液,接下来的一系列操作是搅拌、 、洗涤、 ,最后获得纯净的产品Fe2O3。
Ⅱ.几位同学用铁盐溶液清洗试管中银镜,实验设想如下:
(6)甲:认为含Fe3+的盐无法洗去银镜。依据是Fe3+的氧化性(填“强于”或“弱于”) Ag+的氧化性,所以反应Fe3++Ag→Fe2++Ag+不可以发生。
(7)乙:查资料发现,用FeCl3溶液可以清洗银镜,于是他亲自动手实验,发现银镜迅速消失,另外还观察到溶液变为浅绿色;为验证Fe3+的还原产物,可选择的试剂为 。结合甲的分析和自己的实验现象他得出结论:反应Fe2++Ag→Fe3++Ag是(填“可逆”或“不可逆”) 反应。
(8)丙:结合甲、乙的设想,他用Fe(NO3)3溶液做对比实验,发现清洗银镜的速率慢许多,他重新观察乙的实验试管中有白色沉淀,于是结合化学平衡理论分析,得出用FeCl3溶液清洗银镜的离子方程式: 。
将下列性质的代号,填入各小题后面对应的括号中:
| A.脱水性; |
| B.强酸性; |
| C.难挥发性; |
| D.氧化性; |
E.吸水性
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。()
(2)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。()
(3)用稀硫酸清洗金属表面的氧化物()
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________。
(2)若电解质溶液为硫酸,其正极反应为______________________,
负极反应为_________________。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算:
①电解池阳极生成氯气的物质的量是mol。
②氢氧燃料电池中转移的电子数目是个
消耗H2的质量是g。(写出计算过程)(保留2位小数)
(17分)已知具有碳碳双键结构的有机物可被碱性高锰酸钾溶液氧化成二元醇,如H2C===CH2 HOCH2CH2OH。现以CH2===C(CH3)2为原料按下列方式合成环状化合物D和高分子化合物G。
HOCH2CH2OH。现以CH2===C(CH3)2为原料按下列方式合成环状化合物D和高分子化合物G。
(1)写出F中官能团名称,
(2)A―→B的反应类型是________,C―→E的反应类型是________,
E―→F的反应类型是________。
D的结构简式是____________,G的结构简式是________。
(3)B―→C的化学方程式是_________________________________________。
(4)E―→F的化学方程式是___________________________________________。
(5)C物质的同分异构体中,与C所含官能团种类和数目都相同的同分异构体有________种(不包括C)。写成其中一种物质的结构简式
已知-NH2连在苯环上显碱性,-CONH2连在苯环上显中性。现有分子式为C7H7O2N的有机物,分子结构中有一个苯环和互为对位的两个侧链,试写出该分子式对应的符合下列条件的四种同分异构体的结构简式:
甲:既有酸性,又有碱性________________________________;
乙:只有酸性________________________________;
丙:既无酸性,又无碱性________________________________;
丁:只有碱性________________________________。
焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是。