(14分)工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):
Ph—CH2CH3(g) Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如下图a、b所示。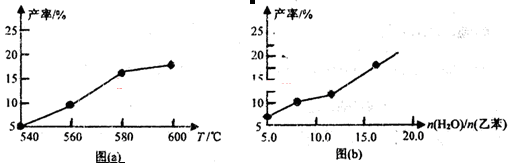
(1)根据反应及上图(a),判断△H 0(填“<”“=”或“>”,下同),△S 0;请选择经济、且适宜的反应温度: 。
(2)下列事实可以说明该反应已达平衡的是 。
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用 的生产条件。实际工业生产中常采用通入水蒸气的方法。水蒸气的含量对反应的影响结果如上图(b)所示。
①在做这四组实验时,应该采用的其他实验条件是 。
A.反应温度相同 B.采用不同的催化剂
C.压强都控制在常压下 D.反应相同时间时测定实验数据
②图(b)表明: 。
③一定温度下,在恒压密闭容器中,通入一定量n(H2O)/n(乙苯)=7:1的气体,发生上述反应,在t1时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在t2时刻重新达到平衡,请在右图中画如反应再次达到平衡过程的图像。
人们生活中使用的化纤地毯、三合板、油漆等化工产品,会释放出某种污染空气的气体A。为使衣服达到防皱、改善手感等效果,在制作过程中也添加A。但衣服中残留的A超标会危害人体健康。A的化学式为,是一种色、有刺激性气味,溶于水, ________毒的气体;新买的衣服若有刺激性气味,有可能是A含量超标,所以,买回服装后应先用水洗,以去掉残留的A。
目前地球环境污染问题越来越严重,如温室效应、臭氧层破坏、光化学烟雾事件、酸雨的形成、有毒物质的污染等已成为世界各国普遍关注和研究的问题。请回答:
(1)产生酸雨的原因主要是大气中含有大量的(填序号,下同)。
A.SO2 B.NO2 C.CO2 D.CO
(2)臭氧层的破坏导致紫外线对地球表面辐射的增加,从而使全球皮肤癌的发病率明显增加。造成这一现象的主要原因是。
A.人们大量使用了氟氯烃
B.人们在炼钢时向空气中排放了大量高炉煤气
C.石油炼制厂排放了大量甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化碳和一氧化氮
(3)在上世纪60年代,一些工业发达国家的城市都相继发生过光化学烟雾事件,并造成数以千计的人员伤亡,光化学烟雾事件产生的主要原因是。
A.汽油的不完全燃烧
B.大量使用了化肥和农药
C.白色塑料垃圾的漂浮
D.金属矿物的冶炼
(4)为了减少大气中二氧化碳的含量,下列措施可行的是。
A.改进能源结构 B.提高能源利用率
C.大量使用化石燃料 D.提倡植树种草
(11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________ _____________。
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。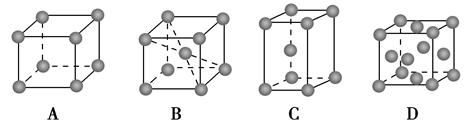

(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于________晶体;
②丙酮中碳原子采取的杂化方式为___;
③CS2属于________(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)________。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为____________________(填化学式)。
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BN、BF3的化学方程式依次是_________、
__________;
(2)BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为______,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
氢气作为一种清洁能源,必须解决它的储存问题, C60可用作储氢材料。
(1)已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ______。
(2)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。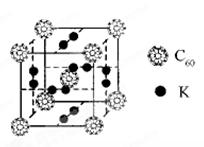
(3)继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。