溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验: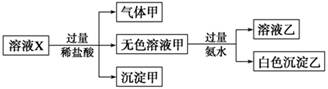
下列判断正确的是
| A.气体甲一定是纯净物 |
| B.沉淀乙为Mg(OH)2 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
D.溶液X中一定存在K+、AlO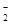 和SiO 和SiO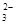 离子 离子 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(还原性I->Fe2 +>Br->Cl-)
+>Br->Cl-)
()
| A.7∶1 | B.7∶2 | C.7∶3 | D.7∶4 |
“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示。下列说法正确的是()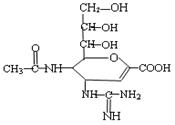
| A.该物质的分子式为C12H19N4O7 |
| B.1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| C.在一定条件下,该物质可以发生消去、加成、取代等反应 |
| D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
下列过程最终无沉淀产生的是()
| A.过量氨气通入Al2(SO4)3溶液 |
| B.CO2通入CaCl2溶液 |
| C.少量SO2通入BaCl2溶液后再通入过量Cl2 |
| D.过量CO2通入Na2SiO3溶液 |
下列分散系不能发生丁达尔现象的是()
| A.豆浆 | B.牛奶 | C.酒精溶液 | D.烟、云、雾 |
下列有关实验的叙述中,合理的是()
①用pH试纸测得氯水的pH为2②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可先将氯化铁溶解在盐酸中,再稀释到所需要的浓度
| A.②④⑥ | B.②③⑥ | C.①②④ | D.②③④⑤⑥ |