对于常温下pH为2的盐酸,传述正确的是()
| A. | 与等体积pH=12的氨水混合后所得溶液显酸性 |
| B. | 由 电离出的 |
| C. | 与等体积0.01 mol•L ﹣1乙酸钠溶液混合后所得溶液中: |
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g)ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g)ΔH 2 =+172.5 kJ·mol-1;则CO还原Fe2O3(s)的热化学方程式为
| A.Fe2O3+ 3CO=2Fe+ 3CO2 △H=-28.5 kJ·mol-1 |
| B.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ |
| C.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H= + 28.5 kJ·mol-1 |
| D.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1 |
下列实验装置图合理的是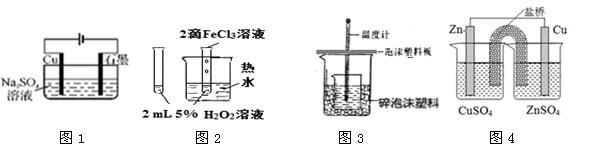
A.装置①所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑ Cu(OH)2+H2↑ |
| B.装置②验证FeCl3对H2O2分解反应有催化作用 |
| C.装置③可用于在实验室测定中和反应的反应热 |
| D.装置④能构成锌铜原电池 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
用湿润的淀粉碘化钾试纸检验气体X |
试纸变蓝 |
X为Cl2 |
| B |
向无色溶液中加盐酸酸化的BaCl2溶液 |
有白色沉淀 |
原溶液中定含SO42- |
| C |
取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 |
X产生氢气的体积比Y多 |
金属性:X>Y |
| D |
向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 |
红色逐渐褪去 |
Na2CO3溶液中存在水解平衡 |
0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
| A.该合金中铜与镁的质量量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL |
下列离子方程式中正确的是
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- =Fe3+ + NO↑+ 2H2O |
| C.铝与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |