硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
xFeSO4·y(NH4)2SO4·zH2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
【探究一】:制备硫酸亚铁铵晶体
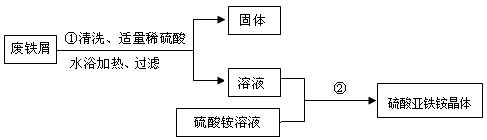
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌。以除去废铁屑表面的油污,这是利用洗涤剂的 作用;
(2)操作①中发生反应的化学方程式为 ;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、 。过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是 ;

(4)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 ;
(5)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ → →d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干。这样做的优点是 ;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验。向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀。
回答下列问题:
(7)实验中生成的NH3能使湿润的 变蓝;写出(NH4)2SO4与NaOH反应的化学方程式 ,属于 反应;
(8)实验中加入过量BaCl2溶液的目的 ;
(9)取最后一次洗涤液,加入Na2SO4溶液, ,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图所示。则:
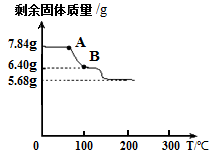
(11)根据图示数据,硫酸亚铁铵晶体中,
x:y:z = ;
(12)写出A点到B点发生反应的化学方
程式 。
黑木耳是一种营养丰富的食用菌,含有人体必需的钙、铁、胡萝卜素、维生素等营养物质,经常食用可补充人体对铁等微量元素的需求。其中营养成分的具体含量如资料卡片所示。请根据资料回答下列问题:

(1)黑木耳中所含的铁是指___________(填字母序号)。
A.分子 B.原子 C.元素
(2)硫酸亚铁(FeSO4)是常见补铁类保健品中的有效成分之一,请根据其化学式计算:
①硫酸亚铁的相对分子质量为 ,
②硫酸亚铁中铁、硫、氧三种元素的质量比为______________________;
③硫酸亚铁中铁元素的质量分数为_____________。(计算结果保留至0.1%)。
某化肥中硝酸铵的化学式为NH4NO3,试回答:
(1)硝酸铵中氮元素的质量分数为 。
(2)市场上销售的某种化肥中,硝酸铵的质量分数为80%,则100克这种化肥中含有氮元素多少克?(请写出解题过程)
硫酸亚铁可用于治疗缺铁性贫血,化学式为FeSO4。根据化学式计算
(1)某贫血患者需补充14g铁,至少需服多少克FeSO4 ?
(2)15.2克FeSO4与多少克Fe2(SO4)3含铁量一样多?
豆浆被称为“植物奶”,其中含有的异黄酮(C15H10O2)具有防癌功能。下列根据异黄酮的化学式进行计算:
(1)异黄酮的相对分子质量为 。
(2)异黄酮中碳元素、氢元素、氧元素的质量比为 。
(3)22.2 g 异黄酮中含有 g 碳元素。
尿素的化学式是CO(NH2)2,请计算:
(1)尿素的相对分子质量。
(2)尿素中各元素的质量比。
(3)120g尿素中氮元素的质量。
(4)某尿素样品中氮元素的质量分数为43.6%,那么该样品中尿素的质量分数是多少(杂质不含氮元素,计算结果精确到0.1%)?