(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为
;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/MPa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2 v (H2)正=" v" (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)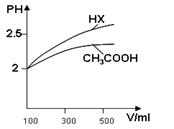
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO−)-c(Na+)=_________mol·L-1(填精确值)。
氯是重要的非金属元素。
30.NaCl和浓硫酸微热制取氯化氢的化学方程式为;
可用试纸放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和;光照新制氯水的化学方程式为;工业是用电解食盐水制取氯气,阴极的电极反应式为:
2H++2e→H2↑,则阳极的电极反应式为。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是______(选填编号)。
a. NaCl Na2SO4 b. NaCl NaBr Na2SO4
c. NaCl Na2SO4 I2 d. NaCl NaI Na2SO4
在一固定容积的密闭容器中,进行如下反应:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
27.反应后物质的总能量增大,则该反应为________反应(填“吸热”或“放热”)。
28.不能判断该反应是否达到化学平衡状态的是________(选填编号)。
a.容器中气体压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(CO)
29.若容器容积为2L,反应10s后测得混合气体的总质量增加了2.4g, 则CO的平均反应速率为mol/(L∙S);若再增加固态碳的量,则正反应的速率(选填“增大”、“减小”、“不变”)。
铁能在稀硝酸中溶解: →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O
24.在上述方程式上标出电子转移的方向和数目。
25.该反应中被还原的元素是,还原剂是。
26.若有0.1 mol铁参加反应,被还原的HNO3为mol。
21.Cl元素位于元素周期表的第三周期族, Cl原子的结构示意图为。
22.不能比较硫、氯的非金属性强弱的是(选填编号)。
a.S2-、Cl-的还原性 b.高氯酸和硫酸的酸性
c.H-Cl键和H-S键的稳定性 d.氯化钠和硫化钠溶液的pH
23.漂粉精可由Cl2通入消石灰中制备,漂粉精的有效成分是;将硝酸银溶液滴入下列物质的溶液中,无明显现象的是(选填编号)。
a.碘化钾 b.氯酸钾 c.氯水d.盐酸
某有机物X的分子式为C4H8O
(1)若X能与NaOH溶液反应,则符合题意的X的结构式有种
(2)若X在酸性条件下与水反应,生成两种有机物Y和Z,Y在铜催化剂下被氧化为W,W能发生银镜反应
①W中所含官能团名称是
②符合题意的X结构有种
③若Y与Z含有相同的碳原子数,写出W与新制氢氧化铜反应的化学方程式。