已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )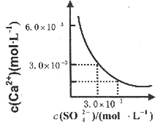
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大 |
在一定温度下向饱和Na2SO4溶液中加入ag无水硫酸钠粉末,搅拌,静置后析出bg Na2SO4·10H2O晶体,(b-a)g是
| A.原饱和溶液失去的水的质量 | B.原饱和溶液中减少的硫酸钠的质量 |
| C.原饱和溶液中失去的水和硫酸钠的总质量 | D.析出的晶体含有的硫酸钠的质量 |
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
| A.3∶2∶1 | B.2∶4∶1 | C.2∶3∶1 | D.4∶2∶1 |
据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是
| A.在此反应中,每生成1molO2(PtF6),则转移1mol电子 |
| B.在此反应中,O2是氧化剂,PtF6是还原剂 |
| C.O2(PtF6)中氧元素的化合价是+1价 |
| D.O2(PtF6)中仅存在离子键不存在共价键 |
下列离子能够大量共存的是
| A.无色溶液中:Fe3+、Na+、NO3-、Cl- |
| B.pH=0的溶液中:Fe2+、NO3-、Cl-、HCO3- |
| C.含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+ |
| D.与铝作用生成氢气的溶液:Mg2+、NO3-、K+、Cl- |
下列表示化学反应的离子方程式,其中正确的是
| A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3 |
B.氯气通入冷水中:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
| C.苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O =2C6H5OH +CO32- |
| D.FeCl3溶液与Cu反应:2Fe3++Cu = 2Fe2++ Cu2+ |