下列离子方程式书写正确的是
①.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3·H2O + H2O
②.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = 4NH4+ + AlO2 – + 2H2O
③.向次氯酸钙溶液中通入过量的二氧化硫 Ca2+ + 2ClO – + SO2 + H2O = CaSO3↓+ 2HClO
④.已知等浓度的碳酸钠、次氯酸钠、碳酸氢钠PH逐渐减小,向次氯酸钠溶液通少量二氧化碳
ClO- +CO2 +H2O =" HClO" + CO32-
⑤.过氧化钠固体与水反应:2O22‾+2H2O=4OH‾+O2↑
⑥.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32‾ +H2O
⑦.澄清的石灰水中加人过量的NaHCO3溶液:Ca2++OH‾+HCO3‾=CaCO3↓+H2O
⑧.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:
2Al3++7OH‾=Al(OH)3↓+AlO2‾+2H2O
⑨、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
| A.①③⑥⑨ | B.②④⑤⑨ | C.③④⑦⑧ | D.①⑧⑨ |
氢核聚变能产生大量的能量,而高纯度铍(Be)是制造核聚变反应装置中最核心的部件之一的屏蔽包的主要材料。据中新网2009年2月6日报道,我国科学家己成功地掌握了获取高纯度铍的技术。下列有关说法错误的是
| A.10Be、9Be、8Be核内质子数均是4 |
| B.Be元素在元素周期表的p区 |
| C.氢核聚变后会产生新元素 |
| D.从矿物中提取单质铍的过程中铍一定被还原 |
下图是已经合成的著名的硫-氮化合物的分子结构。下列说法正确的是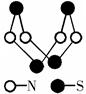
| A.该物质的分子式为SN |
| B.该物质的分子中只有极性键,没有非极性键 |
| C.该物质分子中N-S键键能很大,故其晶体有很大的硬度 |
| D.该物质与化合物S2N2互为同素异形体 |
已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·n NH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是
| A.m=1,n=5 | B.m=3,n=4 |
| C.m=5,n=1 | D.m=3,n=3 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.NaCl和HCl | C.CCl4和KCl | D.NH3和H2O |
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.0.1mol氧化钠固体中离子个数为0.2NA |
| B.1mol金刚石中含C-C键的数目为4NA |
| C.标准状况下,22.4L乙炔中含π键数为2NA |
| D.1mol NaHSO4晶体中阳离子数为2NA |