常温下,对下列四种溶液的叙述正确的是
| |
① |
② |
③ |
④ |
| pH |
10 |
10 |
4 |
4 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为: c(NH4+)>c(Cl-)>c(H+)> c(OH-)
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D.浓度均为0.1 mol·L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③>②>① |
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是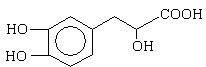
| A.丹参素的分子式为C9H10O5 |
| B.丹参素能发生缩聚、消去、氧化反应 |
| C.1 mol丹参素最多可以和4 mol H2发生加成反应 |
| D.丹参素分子中含有手性碳原子 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向苯酚浊液中加入Na2CO3溶液 |
溶液变澄清 |
酸性:苯酚> HCO3- |
| B |
向乙醇中加入浓H2SO4,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液 |
KMnO4溶液 褪色 |
该气体是乙烯 |
| C |
向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 |
试纸不变蓝 |
溶液X中无NH4+ |
| D |
用湿润的淀粉碘化钾试纸检验气体Y |
试纸变蓝 |
气体Y是Cl2 |
下列有关说法正确的是
| A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液 |
| B.催化剂可以加快化学反应速率但不能改变化学反应的焓变 |
| C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
D.对于反应2SO2(g)+O2(g)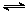 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
短周期元素X、Y、Z、W 的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,X与Z同主族,Y和氢元素同主族,W原子的最外层电子数比次外层电子数少1。下列说法正确的是
| A.元素X形成的单质一定是原子晶体 |
| B.原子半径的大小顺序:r(W)>r(Z)>r(Y) >r (X) |
| C.Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:2 |
| D.W分别与Y、Z形成的化合物中含有的化学键类型相同 |