用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子 NA NA |
B.n = 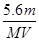 |
C.溶液中H+增加 NA NA |
D.n =  |
0.2 mol某元素的单质直接与Cl2化合后,生成物质质量增加了14.2 g,这种元素的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+5 |
已知钾的氧化物有K2O2和KO2,在两种化合物组成的混合物中,钾与氧的质量比为13∶8,求混合物中K2O2与KO2的物质的量之比。
在下列反应中,假设Cu与HNO3恰好反应
3Cu+8HNO3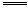 3Cu(NO3)2+2NO↑+4H2O,若有6 mol e
3Cu(NO3)2+2NO↑+4H2O,若有6 mol e 发生转移,则
发生转移,则
(1)被氧化的Cu的物质的量为mol。
(2)被还原的HNO3的物质的量为mol。
(3)未被还原的硝酸的分子个数为个。
(4)生成mol NO。
(5)参加反应的硝酸的物质的量为mol。
对于同质量的二氧化硫和三氧化硫来说,下列关系中正确的是( )
| A.含氧原子的个数比为2∶3 |
| B.含硫元素的质量比为5∶4 |
| C.含氧元素的质量比为6∶5 |
| D.含硫原子的个数比为1∶1 |
标准状况下,将33.6 g铁粉加到一定浓度的硝酸溶液中,两者全部参加反应,同时收集到11.2 L气体(标准状况),下列说法正确的是(设:浓HNO3还原产物为NO2,稀HNO3还原产物为NO)( )
| A.原溶液是浓硝酸,含HNO3的物质的量为3.6 mol |
| B.原溶液必是稀硝酸,含HNO3的物质的量为2.4 mol |
| C.原溶液必是稀硝酸,含HNO3的物质的量为1.6~2.4 mol |
| D.原溶液必是稀硝酸,含HNO3的物质的量为2.0 mol |