高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
A、B、C三种有机物,其相对分子质量都小于150,已知B完全燃烧时所消耗的O2和生成的CO2的物质的量相等,C中碳、氢元素总的质量分数为48.39 %。在热的稀硫酸溶液中,1 mol A水解能生成2 mol B和1 mol C。B不能发生银镜反应,但能与NaHCO3溶液反应放出CO2。回答下列问题:
(1)B的分子组成中氢氧原子个数比为;
(2)有机物C的结构简式为;
(3)有机物A的结构简式为;
(4)写出有机物A水解生成B和C的化学方程式。
下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。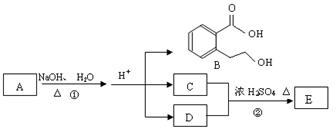
根据上图回答问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为; C分子中的官能团名称是 ______________;化合物B不能发生的反应是(填字母序号):
a.加成反应 b.取代反应 c.消去反应
d.酯化反应 e.水解反应 f.置换反应
(2)反应②的化学方程式是__________________。
(3)A的结构简式是 __________________。
(4)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构
Ⅱ.不属于芳香酸形成的酯
Ⅲ.与 FeCl3溶液发生显色反应。
写出其中任意两个同分异构体的结构简式、。
芳香族化合物C10H10O2有如下的转化关系: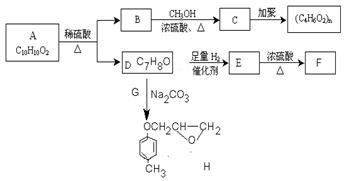
已知F能使Br2/CCl4溶液褪色,且RONa + R’X→ROR’ + NaX
请回答下列问题:
1.写出反应类型。
反应B → C反应 E→F
2.请分别写出A、F的结构简式
AF
3.若有机物M与C互为同分异构体,
则与有机物B互为同系物的M的同分异构体有种。
4. 请写出B→C反应的化学反应方程式
5.请写出D→H反应的化学反应方程式
提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
| 括号内为杂质 |
除杂试剂 |
操作 |
|
| 1 |
乙炔(硫化氢) |
||
| 2 |
溴苯(溴) |
||
| 3 |
硬脂酸钠(甘油) |
||
| 4 |
乙醇(水) |
已知:①具有一个甲基支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色,1molA和1mol NaHCO3能完全反应。②化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3% 。B在催化剂Cu的作用下被氧气氧化成C,C能发生银镜反应。③A和B在浓硫酸加热条件下可生成有水果香味的D。回答下列问题:
(1)写出A的结构简式:________________________
(2)C名称为__________________
(3)写出B的结构简式:___________________________