设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A.1mol苯乙烯(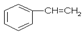 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA |
| B.0.1molCnH2n+2中含有的碳碳单键数为0.1n NA |
| C.2.8 g乙烯和聚乙烯的混合物中所含碳原子数为0.2NA |
| D.标准状况下,2.24LCHCl3含有的分子数为0.1NA |
元素的原子结构决定其性质和在周期表中的位置。下列叙述正确的是
| A.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| B.原子核外电子的数目越多,电子的运动状态就越多 |
| C.轨道表示式,是对原子核外电子运动状态最完美的描述 |
| D.所有元素原子的最外层电子数都等于该元素的最高化合价 |
下列工业生产的主要反应原理不涉及氧化还原反应的是
| A.硝酸工业 | B.接触法制硫酸 | C.合成氨工业 | D.氨碱法制纯碱 |
有关物质结构的表述错误的是
| A.氯乙烯的结构简式:CH2="CHCl" |
B.氮分子的结构式: |
| C.氨分子的空间构型:三角锥形 |
| D.氯离子的最外层电子排布式:3s23p6 |
下列每组物质发生变化所克服的粒子间的作用不属于同种类型的是
| A.金刚石和金属钠熔化 | B.碘和干冰受热升华 |
| C.氯化钠和氯化钙熔化 | D.氯化氢和溴化氢溶于水 |
关于石油和石油化工的说法错误的是
| A.石油的主要成分是碳氢化合物 |
| B.石油分馏得到的各馏分仍是混合物 |
| C.石油裂解气和水煤气的主要成分都是甲烷 |
| D.石油裂解是为得到乙烯、丙烯、丁二烯等化工原料 |