下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
浓硝酸在光照下颜色变黄 |
浓硝酸具有不稳定性 |
| B |
浓硫酸具有酸性和吸水性 |
浓硫酸可使PH试纸先变红后变黑 |
| C |
Cl2和SO2均有漂白性 |
Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| D |
C的还原性小于Si |
可用焦炭和石英在高温下反应制取粗硅和CO2 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
下列说法不正确的是
| A.胶体的分散质粒子直径大小介于溶液与浊液之间 |
| B.金属冶炼通常利用氧化还原反应原理 |
| C.陶瓷、水泥和光导纤维均属于硅酸盐材料 |
| D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
下列化学用语正确的是
| A.乙醇的结构简式:C2H6O |
B.CH4的比例模型: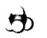 |
C.工业上制取粗硅的化学方程式:SiO2+C Si+CO2↑ Si+CO2↑ |
| D.电解饱和食盐水的离子方程式:Cl-+2H2O=Cl2↑+2OH-+H2↑ |
下列叙述正确的是
| A.沼气和水煤气都是可再生能源 |
| B.石油裂解和油脂皂化都有高分子生成小分子的过程 |
| C.不能用植物油萃取溴水中的溴 |
| D.可以用加热使蛋白质变性的方法分离提纯蛋白质 |
对常温下0.1 mol/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的的c(H+)=1.0×10-13 mol/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.与同浓度的盐酸分别加水稀释10倍后:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |