化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
| A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
| C.向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大 |
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。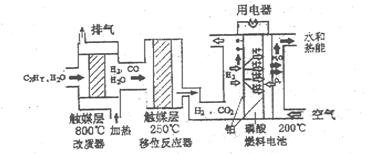
下列说法不正确的是()
|
A.在改质器中主要发生的反应为CXHy+XH2O XCO+(X+Y/2)H2 XCO+(X+Y/2)H2 |
B.移位反应器中CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)  。温度越高,CO转化率越大 。温度越高,CO转化率越大 |
| C.负极排出的气体主要是CO2 | |
| D.该电池正极的电极反应为O2+4H++4e-=2H2O |
下列实验操作及现象与预期实验目的或实验结论不一致的是()
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
向盐酸中滴加水玻璃,用激光笔照射,有丁达尔现象 |
说明有硅酸胶体生成 |
| B |
蔗糖溶液中加入稀硫酸,加热,再加入少量银氨溶液,加热,无银镜生成 |
说明蔗糖未发生水解 |
| C |
浓硫酸和乙醇混合后加热,将产生的混合气体(C2H4、CO2、SO2等)通入酸性高锰酸钾溶液,溶液褪色 |
说明有乙烯产生 |
| D |
在新制的氨水中加入碳酸钙粉末,充分搅拦后,过滤 |
提高氯水中HClO的浓度 |
四氢大麻酚具有抗癌、抗菌、抗呕吐等作用,合成途径如下。下列有关说法正确的是( )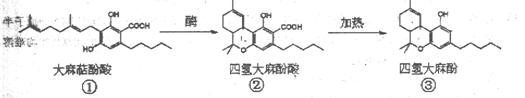
| A.①、②互为同分异构体 |
| B.②、③分子中均含有3个手性碳原子 |
| C.鉴别②、③可用氯化铁溶液 |
D.①、②、③各1mol分别与 足量的溴水反应时,消耗溴的物质的量之比为3:2:3 足量的溴水反应时,消耗溴的物质的量之比为3:2:3 |
下列说法不正确的是()
| A.保护天然气管道时,将铁制管道与电源的正极相连 | |
| B.相同条件下,结合质子的能力:OH->ClO->CH3COO- |
C.电解精炼铜,用粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液 |
| D.在氯化银悬浊液中加入NaBr溶液,沉淀由白色转变为黄色,说明Ksp(AgCl)>Ksp(AgBr) |
下列有关实验原理或操作正确的是()
| A.将氯化镁溶液直接蒸发至干,可获得纯净的无水 MgCl2固体 |
| B.用二氧化锰和0.5mol/L盐酸混合加热,制取氯气 |
| C.用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D.用苯萃取溴的四氯化碳溶液中的溴 |