下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+ N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+ N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是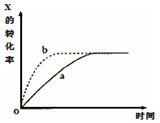
| A.减小体积 | B.加大X的投入量 |
| C.减压 | D.升高温度 |
下列叙述正确的是( )
| A.在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B.若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
| C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
在密闭容器里,A与B反应生成C,其反应速率分别用 、
、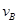 、
、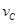 表示,已知2
表示,已知2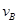 =3
=3 .3
.3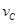 =2
=2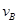 ,则此反应可表示为()
,则此反应可表示为()
| A.3A+B=2C | B.A+3B=2C | C.2A+3B="2C" | D.A+B=C |
已知热化学方程式:SO2(g)+ O2(g) 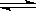 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.<196.64kJ |
| C.196.64kJ/mol | D.>196.64kJ |
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如右图的装置,则对电源电极名称和消毒液的主要成分判断正确的是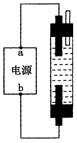
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为阳极,b为阴极;HClO和NaCl |
| C.a为阴极,b为阳极;HClO和NaCl |
| D.a为负极,b为正极;NaClO和NaCl |
已知铅蓄电池放电时发生如下反应:负极:Pb+SO42-―2e―=PbSO4,正极:PbO2+4H++SO42-+2 e―=PbSO4+2H2O,当铅蓄电池放电转移的电子能氧化Cl-制得Cl2 22.4L(标况)时,电池内消耗的硫酸的物质的量至少是()
| A.2.5 mol | B.2 mol | C.1 mol | D.5 mol |