H2S在水中的电离方程式为 。
(1)向H2S溶液中加入浓盐酸时,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(2)向H2S溶液中加入NaOH固体,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入 。
(4)向H2S溶液中加水,c(HS-) (填增大、减小、不变),溶液pH (填增大、减小、不变)
(2)在以上中性溶液中,继续滴加Ba(OH)2(aq),请写出此步反应的离子方程式_______________。
(1)将NaAlO2(aq)和AlCl3(aq)混合:(水解相互促进,反应进行到底,下同);
(2)将10.00 mL 0.10 mol·L-1的NaHCO3(aq)与5.00 mL 0.10 mol·L-1的KAl(SO4)3(aq)混合:。
(1)__________________________________;
(2)__________________________________;
(3)__________________________________(可不写满,也可补充)。
(10分)已知:A、F为金属单质,D、E为气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如下图所示(部分生成物已略去):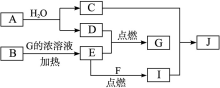
(1)A的原子结构示意图为________,B的化学式为________。
(2)写出反应C+I→J的离子方程式:__________________________________。
(3)写出E+F→I的化学反应方程式为__________________________________,
D在E中点燃时的现象为___________________________________________。
(8分)有一瓶澄清的溶液,其中可能含有K+、Na+、Ba2+、Mg2+、Fe3+、Cl-、CO、SO,取该溶液进行如下实验:
(1)取pH试纸检验,表明溶液呈强酸性,排除________存在。
(2)另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则可排除________、________离子的存在。
(3)取上述碱性溶液加Na2CO3溶液,有白色沉淀生成,可排除________离子的存在。
(4)根据以上实验事实确定:该溶液中肯定存在的离子是________、________;可能存在的离子是________、________。