CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 |
0 |
1 |
2 |
3 |
4 |
| CH4 |
0.2mol·L—1 |
0.13 mol·L—1 |
0.1 mol·L—1 |
0.1 mol·L—1 |
0.09 mol·L—1 |
| H2 |
0 mol·L—1 |
0.2 mol·L—1 |
0.3 mol·L—1 |
0.3 mol·L—1 |
0.33 mol·L—1 |
①3—4min之间,化学平衡向___ ____反应方向移动(填“正”或“逆”)。
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。

请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___(填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是溶液,装置C中应盛放的试剂是________。
(2)观察实验装置图可知Na与CO2反应的条件是_____________。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现现象时,再点燃酒精喷灯,这步操作的目的是。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。。
工业合成氨与制备硝酸一般可连续生产,流程如下: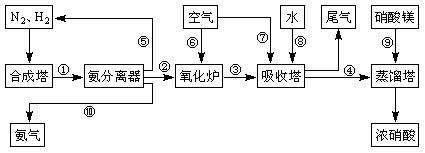
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
| T/K |
T1 |
573 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
T1____573K(填“>”、“<”或“=”)。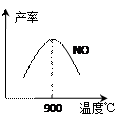 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因。
(4)吸收塔中发生反应的化学方程式为:
。
(5)上述工业流程中,采用了循环操作工艺的是(填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
某课外活动小组同学用下图装置进行实验,试回答下列问题: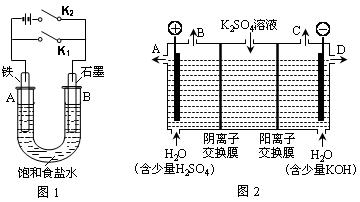
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为(填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷第7页 (共12页)
①U型管里总反应的离子方程式为
②对于上述实验,下列说法正确的是(填序号)。
| A.溶液中Na+向B极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA |
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因。
已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)写出X、Y的元素符号:X、Y;
(2)W在元素周期表中的位置是;Z的原子结构示意图
(3)由X、Y、Z所形成的离子化合物的化学式是,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是;
(4)用电子式表示Y的氢化物的形成过程。
在下列事实中,什么因素影响了化学反应速率?
(1)熔化的KClO3放出气泡很慢,加入少量MnO2后很快产生气体_____________;
(2)同浓度、同体积的盐酸放入同样大小的锌块和镁块,产生气体有快有慢_____________;
(3)夏天的食品易变霉,冬天就不易发生该现象_____________。