【化学–选修2:化学与技术】
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下: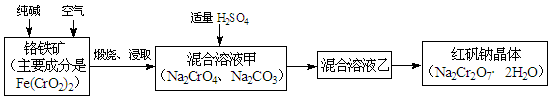
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
(1)二氧化硅晶体中,每个硅原子周围有________个氧原子,每个氧原子周围有________个硅原子,硅氧原子个数比为________。
(2)石墨晶体结构如图所示,每一层由无数个正六边形构成。
平均每个正六边形所占有的碳原子数目为________、
平均每个正六边形所占有的共价键数目为________。
在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有(填数字)个碳原子,每个碳原子上的任意两个C—C键的夹角都是(填角度).
氯化钠属于 晶体,二氧化硅属于 晶体,NaCl和SiO2并不代表它们的 式,只能表示组成晶体的各种微粒的 。
榴石矿石可以看作CaO、Fe2O3、Al2O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是________。
(2)对溶液Ⅰ进行操作时,控制溶液pH=9~10 (有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致_________溶解,沉淀。
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Ca(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
12.0 |
(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式。
(4)①某同学在实验室中用图1装置制取CO2气体并通入溶液Ⅱ中,结果没有沉淀产生,可能的原是;为了能产生沉淀,该同学对图1装置进行了改进,改进的方法为。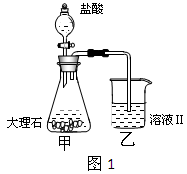
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系。
运用相关原理,回答下列各小题:
已知:NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42-
(1)常温下,pH=5的NaHSO4溶液中水的电离程度pH=9的NH3·H2O中水的电离程度。(填 “>”、“=”或“<”)
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为。(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则[Na+]+[NH4+]2[SO42-](填 “>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH7。(填“>”、“=”或“<” )
(3)将分别含有MnO4-、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH值,使pH=1,
充分反应后:
①若I-离子有剩余,上述四种离子在溶液中还存在的有,一定不存在的是。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有,
一定不存在的离子有。