【化学——选修5:有机化学基础】
合成生物碱类天然产物的重要步骤之一是脱水环化,某生物碱F的合成路线,如下图所示:(图中的R,R′,R″均代表烃基)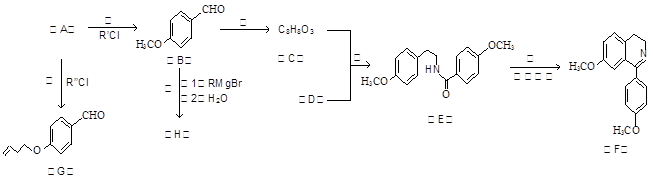
已知以下信息:
①A为芳香族化合物,只含C、H、O三种元素,1molA完全燃烧需消耗7.5molO2。
②分子中含有“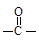 ”结构的物质可发生下列反应:
”结构的物质可发生下列反应: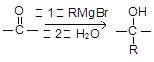
③两个羟基连接在同一个碳原子上时极不稳定,容易脱水: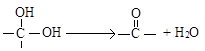
④合成路线中Ⅰ和Ⅴ反应原理相同;Ⅲ和Ⅳ均有水生成;
回答下列问题。
(1)反应Ⅴ中的R″Cl的系统命名为 ,B中官能团的名称为 。
(2)下列叙述正确的是 。
a.仅用新制Cu(OH)2可以鉴别A、B、C三种物质
b.D与PPA(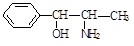 )互为同分异构体
)互为同分异构体
c.E和G均可发生加成反应、水解反应
d.F的分子式为C17H17NO2
(3)某化合物结构简式为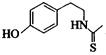 ,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式 。
,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式 。
(4)若H与G互为同分异构体,且H可发生消去反应,写出符合要求的H结构简式(任写一种)
。
(5)根据已有知识并结合相关信息,完成以下由X和CH3MgBr为原料制备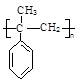 的合成路线流程图:
的合成路线流程图: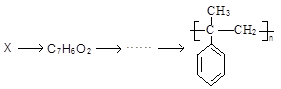
注:①X与B互为同分异构体,X的核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1.
②无机试剂任用,有机物用结构简式表示,合成路线流程图示例如下: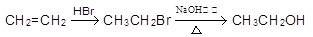
有机锌试剂(
)与酰氯( )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ:
(1)化合物Ⅰ的分子式为。
(2)关于化合物Ⅱ,下列说法正确的有(双选)。
| A. | 可以发生水解反应 |
| B. | 可与新制的 共热生成红色沉淀 |
| C. | 可与 溶液反应显紫色 |
| D. | 可与热的浓硝酸和浓硫酸混合液反应 |
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径1合成线路的表示方式,完成途经2中由Ⅲ到Ⅴ的合成路线:(标明反应试剂,忽略反应条件)。
(4)化合物Ⅴ的核磁共振氢谱中峰的组数为,以H替代化合物Ⅵ中的
,所得化合物的羧酸类同分异构体共有种(不考虑手性异构)。
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为:。
"司乐平"是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。
(1)下列关于
的说法正确的是(填序号)。
a.属于芳香族化合物
b.遇
溶液显紫色
c.能使酸性高锰酸钾溶液褪色
d.1
完全水解生成2
醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下: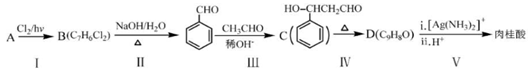
已知:
①烃
的名称为。步骤I中
的产率往往偏低,其原因是。
②步骤II反应的化学方程式为。
③步骤III的反应类型是.
④肉桂酸的结构简式为。
⑤
的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有种。
(15分)四苯基乙烯(
)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):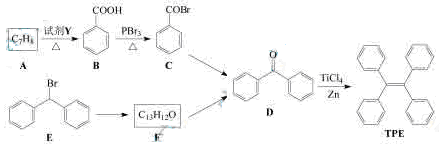
(1)
的名称是;试剂
为。
(2)
的反应类型为;
中官能团的名称是,
中官能团的名称是.。
(3)
的化学方程式是。
(4)
是
的同分异构体,具有下列结构特征:①属于萘(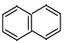 )的一元取代物;②存在羟甲基(
)。写出W所有可能的结构简式:。
)的一元取代物;②存在羟甲基(
)。写出W所有可能的结构简式:。
(5)下列叙述正确的是。
a.
的酸性比苯酚强b.
不能发生还原反应
c.
含有3种不同化学环境的氢d.
既属于芳香烃也属于烯烃
Ⅰ下列有关海水综合利用的说法正确的是
| A. | 电解饱和食盐水可制得金属钠 | B. | 海带提碘只涉及物理变化 |
| C. | 海水提溴涉及到氧化还原反应 | D. | 海水提镁涉及到复分解反应 |
Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。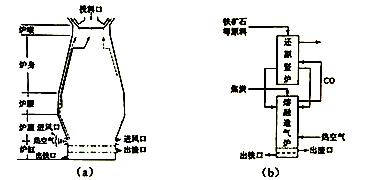
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有。除去铁矿石中脉石(主要成分为
)的化学反应方程式为、;高炉排出气体的主要成分有
、
和填化学式)。
(2)已知:①
②
③
则反应
的
=
。理论上反应放出的热量足以供给反应所需的热量(填上述方程式序号)
(3)有人设计出"二步熔融还原法"炼铁工艺,其流程如图(
)所示,其中,还原竖炉相当于高炉的部分,主要反应的化学方程式为;熔融造气炉相当于高炉的部分。
(4)铁矿石中常含有硫,使高炉气中混有
污染空气,脱
的方法是。
[选修3-物质结构与性质]
Ⅰ下列物质的结构或性质与氢键无关的是()
| A. | 乙醚的沸点 | B. | 乙醇在水中的溶解度 |
| C. | 氢化镁的晶格能 | D. | 的双螺旋结构 |
Ⅱ钒(
)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为,其价层电子排布图为。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为、。
(3)
常用作
转化为
的催化剂。
分子中
原子价层电子对数是对,分子的立体构型为;
气态为单分子,该分子中
原子的杂化轨道类型为;
的三聚体环状结构如图2所示,该结构中
原子的杂化轨道类型为;该结构中
-
键长由两类,一类键长约140
,另一类键长约为160
,较短的键为(填图2中字母),该分子中含有个
键。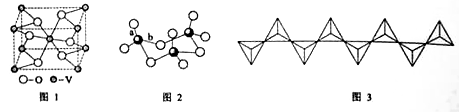
(4)
溶解在
溶液中,可得到钒酸钠(
),该盐阴离子的立体构型为;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为。