25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,正确的是
A.加NaOH,HA电离平衡常数增大
B.通入HCl,溶液中阴离子浓度之和减小
C.溶液中水的电离程度a>b>c
D.b点溶液中,c(HA)<c(A-)
下列化合物的分子中,所有原子都处于同一平面的有( )
| A.乙烷 | B.甲苯 | C.氟苯 | D.四氯乙烯 |
下列有关生活中常见的有机物的说法正确的是( )
| A.汽油、苯、乙醇都属于烃类物质 |
| B.含5个碳原子的有机物,每个分子中最多可形成5个碳碳单键 |
| C.乙醇能被氧化成乙酸,两者都能与金属钠反应 |
| D.煤的干馏可得煤油;甲烷、乙烯和苯能通过石油分馏得到 |
β--紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。 下列说法正确的是( )
下列说法正确的是( )
| A.β--紫罗兰酮可使酸性KMnO4溶液褪色 |
| B.1mol中间体X最多能与2mol H2发生加成反应 |
| C.维生素A1易溶于NaOH溶液 |
| D.β--紫罗兰酮与中间体X互为同分异构体 |
下列各组中的反应,属于同一反应类型的是( )
| A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
| B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 |
| C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 |
| D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 |
某物质的结构为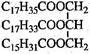 ,关于该物质的叙述正确的是( )
,关于该物质的叙述正确的是( )
| A.一定条件下与氢气反应可以生成硬脂酸甘油酯 |
| B.一定条件下与氢气反应可以生成软脂酸甘油酯 |
| C.与氢氧化钠溶液混合加热能得到肥皂的主要成分 |
| D.与其互为同分异构体且完全水解后产物相同的油脂有三种 |