对于反应aA+bB=dD+eE,该化学反应速率定义为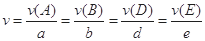 。式中
。式中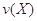 指物质
指物质 的反应速率,
的反应速率, 、
、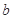 、
、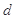 、
、 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 |
1 |
2 |
3 |
4 |
| c(HI)/ mol·L-1 |
0.100 |
0.200 |
0.300 |
0.100 |
| c(H2O2)/ mol·L-1 |
0.100 |
0.100 |
0.100 |
0.200 |
| v/ mol·L-1·s-1 |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
以下说法正确的是
A.实验1、2中,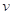 (H2O2)相等
(H2O2)相等
B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时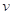 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1
C.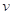 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数
D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
分析推理是化学学习的方法之一。下列实验推理中,正确的是()
| A.金属的冶炼方法与金属的活泼性有很大关系,所以银和汞可以用热分解的方法冶炼 |
| B.钠比铜活泼,所以钠可以从硫酸铜溶液中置换出铜 |
| C.工业上电解熔融氯化镁可制得金属镁,所以工业上电解熔融氯化铝可制得铝 |
| D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼 |
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的有
| A.用滴定管量取液体时,开始时平视读数,结束时俯视读数; |
| B.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 |
| C.定容时,俯视容量瓶的刻度线; |
| D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中。 |
室温下, 下列各组离子在指定溶液中能大量共存的是
下列各组离子在指定溶液中能大量共存的是
| A.饱和氯水中 Cl-、NO3-、Na+、SO32- |
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42 -、Br- -、Br- |
| C.Na2S溶液中 SO42-、 K+、Cl-、Cu2+ |
| D.pH=12的溶液中 NO3-、I-、Na+、Al3+ |
下列说法正确的是
| A.将25g CuSO4·5H2O溶于1L水中,可配制成0.1 mol·L-1CuSO4溶液 |
| B.往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 |
| C.用向下排空气法收集NH3,并用湿润的蓝色石蕊试纸检验NH3,是否收集满了 |
| D.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生 |
物质发生化学变化时,反应前后肯定不发生变化的是
①电子总数 ②原子总数 ③质子总数 ④物质的总质量
⑤物质的总能量 ⑥物质的种类
| A.①②③④⑤ | B.①②③④ | C.②⑤⑥ | D.③④⑤⑥ |