NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
硒34Se和碲52Te都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上用硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
已知:
(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是。
(3)废气的主要成分是____;废渣II的主要成分是。
(4)步骤④中主要反应的化学方程式是;步骤⑥反应的化学方程式是。
(5)根据表中数据,步骤⑤最适宜的分离方法是。
有机物5一甲基 是一种医药合成中间体,某同学设计它的合成路线如下:
是一种医药合成中间体,某同学设计它的合成路线如下:
(1)①的反应类型是。
(2)E的结构简式是。
(3)A的结构简式是;③的反应条件和所需无机试剂是。
(4)下列有关5一甲基茚( )的说法正确的是(填序号)。
)的说法正确的是(填序号)。
| A.一定条件下能与卤素单质发生取代反应 |
| B.1 mol该物质最多与4 mol H2发生加成反应 |
| C.一定条件下能发生加聚反应生成高分子化合物 |
| D.与溴的四氯化碳溶液反应得到的产物不能使高锰酸钾酸性溶液褪色 |
(5)反应⑧的化学方程式是。
(6)满足下列条件的G的同分异构体有种;写出其中一种的结构简式。
①分子中含有苯环且苯环上只有一个取代基;②能发生银镜反应。
2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温 B.降温 C.加压 D.减压 E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。
(4)工业上可利用如下反应:H2O (g)+CH4 (g) CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下: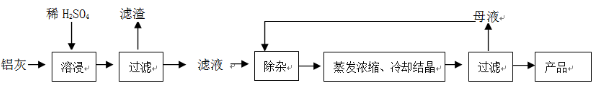
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
2.7 |
| 完全沉淀时 |
5.2 |
9.7 |
3.2 |
(1)H2SO4溶解A12O3的离子方程式是;
(2)检验滤液中还存在Fe2+的方法是(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的;调节溶液的pH为3.2的目的是。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是,写出其反应方程式;
③Ⅲ中加入MnSO4的目的是。
(4)从多次循环使用后母液中可回收的主要物质是(填化学式)。
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g) =2CO2(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
则CO(g) + 2H2(g)  CH3OH(g) △H=。
CH3OH(g) △H=。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H0(填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H0(填>、<或=)。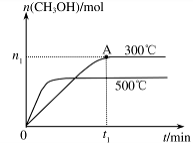
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数(结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数(结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
①B极的电极反应式为。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀(填“能”或“否”)。