几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
R |
Q |
|
| 原子半径(×10-10 m) |
1.86 |
0.99 |
1.43 |
1.60 |
0.75 |
0.74 |
|
| 主要化合价 |
最高正价 |
+1 |
+7 |
+3 |
+2 |
+5 |
—— |
| 最低负价 |
—— |
-1 |
—— |
——- |
-3 |
-2 |
下列说法正确的是
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Y、M的单质分别与水反应,Y最剧烈
C.X、Z、R的最高价氧化物的水化物之间可两两相互反应
D.Y的氧化物水化物的酸性一定强于R的的氧化物水化物的酸性
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题。在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是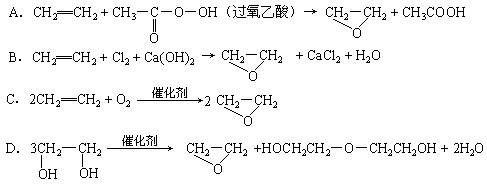
现有①NH4Cl、②H2、③MgCl2、④CO2、⑤NaOH、⑥Na2O2六种物质中,属于离子化合物又含共价键的是
| A.①③⑤⑥ | B.①④⑤⑥ | C.①⑤⑥ | D.⑤⑥ |
下列有关能量转化的认识,不正确的是
| A.植物的光合作用使得太阳能转化为化学能 |
| B.人类使用照明设备是将电能转化为光能 |
| C.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| D.燃料燃烧时只是将化学能转化为热能 |
A元素原子L电子层比B元素原子的L电子层多3个电子,B元素原子核外电子总数比A 元素原子电子总数少5个,则A、B可形成
A.AB B.A2B C.B3A2 D.A3B2
以下处理废干电池方法不当的是
| A.把锌皮取下洗净,用于实验室制氢气 | B.用碳棒作电极 |
| C.把铜帽取下回收利用 | D.将废电池中的糊状物作化肥 |