某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g; ②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol·L-1的硫酸溶液恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是( )
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
1mol某烃最多能和2molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和8molCl2发生取代反应,生成只含碳元素和氯元素的氯代烷,该烃可能是()
| A.CH3CH=CH2 | B.CH2=CHCH=CH2 | C.CH3=CHCH3 | D.CH3-C≡CH2-CH3 |
 是由一种单烯烃加氢而成的,那么原烯烃的可能结构有
是由一种单烯烃加氢而成的,那么原烯烃的可能结构有
| A.1种 | B.2种 | C.3种 | D.4种 |
设NA为阿伏加德罗常数,则下列说法不正确的是()
| A.在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
| B.1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA |
| C.14g乙烯和环丙烷混合物中含有的碳原子数目为NA |
| D.0.1mol乙烷分子中含有的共价键数目为0.7NA |
四联苯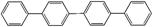 的一氯代物有()
的一氯代物有()
| A.3种 | B.4种 | C.5种 | D.6种 |
以下四种有机物的分子式皆为C4H10O:
其中能被氧化为含相同碳原子数醛的是()
| A.①和② | B.只有② | C.②和③ | D.③和④ |