已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法不正确的是 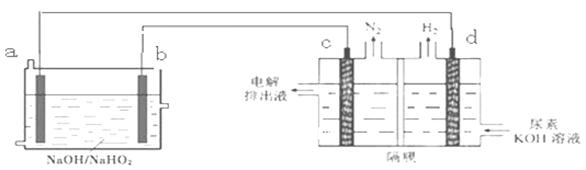
| A.燃料电池的总反应为:2Al+3HO2-= 2AlO2- + OH- +H2O |
| B.电极b是正极,且反应后该电极区pH增大 |
| C.电解过程中,电子的流向由a→b→c→d. |
| D.电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
下列反应中属于氧化还原反应,但是H2O既不是氧化剂,又不是还原剂的是
| A.NaH+H2O = NaOH+H2↑ | B.2Na2O2+2H2O = 4NaOH+O2↑ |
| C.CaO+H2O = Ca(OH)2 | D.2F2+2H2O = 4HF+O2 |
下列除杂质选用试剂错误的是
| 编号 |
物质 |
杂质 |
试剂 |
| A |
FeCl3 |
FeCl2 |
氯气 |
| B |
Cl2 |
HCl |
饱和食盐水 |
| C |
SiO2 |
Fe2O3 |
盐酸 |
| D |
CO2 |
CO |
O2 |
下列关于硫酸及硫酸盐的说法正确的是
| A.常温下足量的铁与浓硫酸反应,会产生SO2与H2的混合气体 |
| B.将浓盐酸滴加到浓硫酸中会产生白雾,可以用浓硫酸的脱水性来解释 |
| C.硫酸钡作为“钡餐”的原因之一是其对肠胃疾病有治疗效果 |
| D.浓硫酸与铜在加热条件下的反应既体现了浓硫酸的强氧化性,又体现了酸性 |
将一块银白色的金属钠长时间放在空气中会发生一系列的变化:表面变暗→“出汗”→白色粉末。下列有关叙述中不正确的是
| A.表面迅速变暗是因为钠与空气中的氧气反应生成氧化钠 |
| B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 |
| C.最后的白色粉末是碳酸钠 |
| D.该过程中的所有化学反应均为非氧化还原反应 |
下列实验操作正确的是
| 实验 |
操作 |
|
| A |
实验室用自来水制备蒸馏水 |
将自来水倒入烧杯中,小心给烧杯加热 |
| B |
配制一定浓度的氯化钾溶液100 mL |
将称好的氯化钾固体放入100 mL容量瓶中,加水溶解,振荡摇匀,定容 |
| C |
除去粗盐溶液中的Ca2+、SO42-、Mg2+ |
依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液均至过量,过滤后再加适量盐酸 |
| D |
取出分液漏斗中的上层液体 |
下层液体从分液漏斗下端放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端放出 |