常温下,浓度均为0.1mol/L的溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(NH4+)+c(NH3·H2O)=0.05mol/L |
| D.①和③等体积混合后的溶液pH>7:c(NH4+)>c(Cl—)>c(OH-)>c(H+) |
下列变化的离子方程式书写正确的是
A.将少量AgNO3溶液滴入氨水中: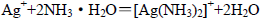 |
B.将少量SO2通入NaClO溶液中: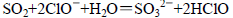 |
C.澄清石灰水与稀硝酸反应: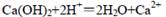 |
D.水玻璃长时间放置在空气中: |
下列说法正确的是
| A.在一定温度下,AgCl水溶液中Ag+和Cl—浓度的乘积是一个常数 |
| B.催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C.应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D.由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
据统计,截至2013年1月13日零时,在全国74个监测城市中,有33个城市的部分检测站点所检测的数据显示空气质量属于严重污染,下列说法不正确的是
| A.在空气质量报告的各项指标中,有二氧化硫和二氧化氮的指数 |
| B.对煤燃烧后形成的烟气脱硫是防治酸雨的措施之一,石灰法是目前应用最广泛的废气脱硫方法 |
| C.大气中二氧化硫和二氧化氮超标会形成酸雨,正常雨水的pH值为7,酸雨的pH值小于7 |
| D.汽车尾气是造成大气污染的重要原因之一,其主要成分是氮氧化物、一氧化碳、未燃烧的碳氢化合物和颗粒物等 |
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下三种测定方法。
I.氧化还原法:甲同学根据化学反应原理SO2+I2+2H2O=H2SO4+2HI设计了如下图所示的装置进行实验:
(1)该实验需80ml浓度为5×10-4mol/L的碘
溶液,甲同学应选择ml的容量瓶进行配制。
(2)广口瓶中使用多孔球泡的目的是。
(3)在甲同学所配碘溶液浓度准确,并且量取药品及 实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因(至少写两种原因)
II.重量法:乙同学拟用实验室常用仪器组成简易装置测定空气中的SO2含量。实验操作过下:
按如下实验装置图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20ml的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀(H2SO4+BaCl2=BaSO4↓+2HCl),经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.18mg。
(4)取样处空气中SO2含量为mg/L(精确到0.001)。
(5)现查阅资料知,常温下BaSO3的Ksp为5.48×10-7,饱和亚硫酸溶液中c(SO32-)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.lmol/L BaCl2溶液来吸收SO2即可产生沉淀,你认为这样做(填“正确”或“不正确”),请利用以上数据简述理由。
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4。
(6)请写出该电池负极的电极反应式:。
一定温度下,在密闭容器内有如下化学反应平衡:CO+H2O(g)  H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
| A.0.5mol | B.0.6mol | C.0.9mol | D.2.5mol |