25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是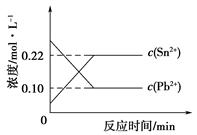
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂就把它们区别开来了,这种试剂是
| A.盐酸 | B.氢氧化钠溶液 | C.氯化钡溶液 | D.硝酸 |
浓度为0.01mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有的C(H+) 等于
| A.0.05mol/L | B.0.001mol/L | C.0.002mol/L | D.0.005mol/L |
下列反应的离子方程式正确的是
| A.氧化铜与硫酸混合:O2-+2H+=H2O |
| B.澄清的石灰水跟盐酸反应:Ca2++2Cl-= CaCl2 |
| C.Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D.石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
某溶液中仅有5种离子,其中含有4n个Na+ , 2n个K+,n个Cu2+离子,3n个SO42-,则溶液中NO3-的个数为
| A.n | B.2n | C.3n | D.4n |
下列能在溶液中大量共存的一组离子是
| A.Cu2+、SO42-、OH-、K+ | B.Na、CO32-、H+、Cl- |
| C.H+、Cl-、NO3-、Ba2+ | D.Ca2+、H+、CO32-、NO3- |