下列有关化学用语表示正确的是
A.HClO的电子式: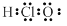 |
B.硫离子结构示意图: |
| C.丙醛的结构简式:CH3CH2COH | D.碳酸的电离方程式:H2CO3 2H++CO32- 2H++CO32- |
某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为 [Al2(OH)nClm·yH2O]X,式中m等于 ( )
| A.3-n | B.6-n | C.6+n | D.3+n |
北京在申办2008年奥运会时提出了"科技奥运、人文奥运、绿色奥运"的口号。为了把2008年北京奥运会办成“绿色奥运”,下列做法不可取的是 ( )
| A.关闭所有化工厂 | B.用天然气逐步取代民用燃煤 |
| C.提高污水处理率 | D.降低机动车辆尾气污染 |
光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成 ( )
| A.碳 | B.石英 | C.锗 | D.硅 |
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为()
| A.28 | B.60 | C.32 | D.4 |
标准状况下,①6.72L NH3②1.204×1023个 H2S③5.6g CH4④0.5mol HCl ,下列关系正确的是()
| A.体积大小:④>③>②>① | B.原子数目:③>①>④>② |
| C.密度大小:④>②>③>① | D.质量大小:④>③>②>① |