已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为
__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。
(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(11分)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。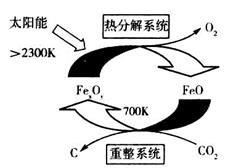
①若“重整系统”发生的反应中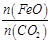 =6,则FexOy的化学式为______________。
=6,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)=2CH3OH △H2=+23.4kJ·mol-1
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3=kJ·mol-1
CH3OCH3(g)+3H2O(g) △H3=kJ·mol-1
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的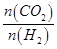 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。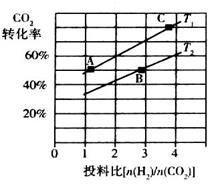
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率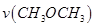 =______;KA、KB、KC三者之间的大小关系为______________。
=______;KA、KB、KC三者之间的大小关系为______________。
Ⅰ.图甲是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):。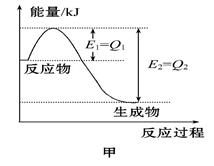
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g)="=" 2NH3(g) ΔH="-92.4" kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l)="=" 4NH3(g)+3O2(g) ΔH=;
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下, NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图乙: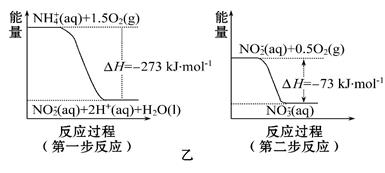
1 mol NH4+全部被氧化成NO3-的热化学方程式为。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为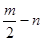 。请回答下列问题:
。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲+ H2O → 丙+ 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是,丁与H2O有相同的电子总数,则丁的化学式为。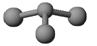
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式)。
(5)写出B与D在高温下完全反应后生成物的电子式___ __,结构式___
【化学——选修3:物质结构与性质】A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素。A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)D的基态原子价层电子排布式为__________ 。
(2)C的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________。
(3)A、C电负性大小顺序是_______(用元素符号表示),C的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)A、B形成的化合物的晶胞如图所示,该晶胞的化学式为_________,其中A离子的配位数为__________,该晶体类型为___________。
(5)该晶胞的边长为a pm(NA表示阿伏伽德罗常数),则该晶胞的密度为______g/cm3(列出算式)。
含铬污水处理是污染治理的重要课题。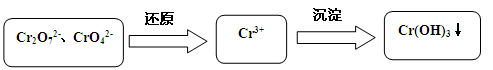
污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:
(1)加酸可以使CrO42-转化为Cr2O72-: 2CrO42- + 2H+ Cr2O72-+ H2O,若常温下pH=1溶液中Cr2O72-浓度为0.1 mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=。
Cr2O72-+ H2O,若常温下pH=1溶液中Cr2O72-浓度为0.1 mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降低到10-5mol•L-1,溶液的pH应升高到。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为。