根据A物质和B物质的溶解度曲线,回答下列问题: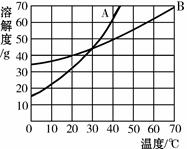
(1)20℃时,将35g A物质和35g B物质分别放入盛有100g水的烧杯中,充分搅拌,溶液达到饱和的是 (填“A”或“B”)。
(2)溶解度曲线A与B的交点P的含义是 。
(3)C物质的溶解度如下表,请在上图中描出C物质的溶解度曲线。
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 溶解度/g |
40 |
33 |
27 |
23 |
18 |
14 |
10 |
请回答下列生活中的有关问题。
(1)鸡蛋中主要含有的营养素是______(填“糖类”或“蛋白质”);能补充维生素C的食物有______。
(2)把磨好的豆浆倒在纱布袋中将渣和浆分离,相当于实验操作中的__________。
(3)若家中阳台上的玫瑰花生长不茂盛,叶子发黄。你认为需要施加下列肥料中的__________(填序号);从外观上能区分出的是__________(填序号)。
| A.硫酸钾 | B.硝酸铵 | C.磷矿粉 | D.氯化钾 |
高温、碱性溶液、高锰酸钾或次氯酸钠等都可以杀死禽流感病毒。请回答:
(1)次氯酸钠(NaClO)中氯元素的化合价为__________。
(2)如果用加热高锰酸钾的方法熏蒸鸡舍,则其受热分解的化学方程式为__________________。
(3)欲用烧碱配制200 g 2%的NaOH溶液用于消毒,现有仪器:药匙、胶头滴管、天平、烧杯、玻璃棒,还缺少的仪器是__________(填名称)。
认真分析下列各图,回答相关问题。
(1)根据图1分析,20℃时,将20 g NaCl加入50 g水中形成溶液的质量为__________。
(2)图2中打开汽水瓶冒出大量气泡,说明气体的溶解度与__________有关。
(3)在图3所示的烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象是________________;乙试管内的溶液是__________(填“饱和”或“不饱和”)溶液。
请用元素或化学式表示。
(1)2个氮原子:__________;
(2)3个氧分子:__________;
(3)五氧化二磷:__________;
(4)天然气或沼气的主要成分:__________。
点燃不纯的可燃性气体可能发生爆炸,如下图是某同学的改进装置。请回答:
(1)图甲是可燃性气体的洗气改进装置,若在导管a处通入可燃性气体,在导管b处连上尖嘴管并松开止水夹,点燃,即使气体不纯也不会爆炸,可见此装置的作用是____________。
(2)用图乙尖嘴管导出可燃性气体并点燃,也不会使管中气体爆炸,其原理是铜丝或水可以____________。