常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是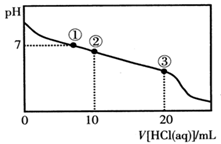
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |
下列说法正确的是()
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
下图为铅蓄电池的示意图。下列说法正确的是()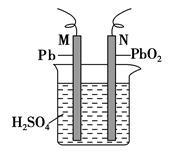
| A.放电时,N为负极,其电极反应式为:PbO2+SO+4H++2e-===PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-===Pb+SO |
| D.充电时,若N连电源正极,则该极生成PbO2 |
某温度下反应H2(g)+I2(g) 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L-1 H2(g)、0.5 mol·L-1I2(g)及0.3 mol·L-1HI(g),则下列说法中正确的是()
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L-1 H2(g)、0.5 mol·L-1I2(g)及0.3 mol·L-1HI(g),则下列说法中正确的是()
| A.反应正好达到平衡 |
| B.反应向左进行 |
| C.反应向某方向进行一段时间后K<57.0 |
| D.反应向某方向进行一段时间后[H2]<0.2 mol·L-1 |
将下图所示实验装置的K闭合,下列判断正确的是()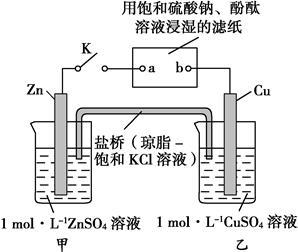
| A.Cu电极上发生还原反应 |
| B.电子沿Zn→a→b→Cu路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol· L-1的一元酸HA与b mol· L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是()
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,[H+]=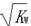 mol·L·-1 mol·L·-1 |
| D.混合溶液中,c(H+)+c(B+)===c(OH-)+c(A-) |