硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为______;生成SO3的化学反应速率为______。
(2)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 | C.充入大量的氮气 | D.仅增加SO2的浓度 |
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:____ _
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。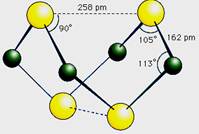
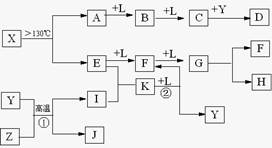
试回答下列问题
(1)写出化学式:DX 。
(2)E的电子式为:。
(3)写出化学方程式:①;②。
X、Y、Z三种元素的原子,核外均未出现3d电子。已知:1、 X+和Y-两种离子具有相同的核外电子排布类型;2、 Z元素原子核内的质子数比Y元素原子核内的质子数少9。 请回答下列问题:
(1)写出X、Y、Z三种元素的元素符号X,Y, Z。
(2)Y元素能形成多种含氧酸,其中酸性最强的含氧酸的化学式为 。
(3)含有这三种元素的一种化合物常在实验室中用来制备O2,写出该反应的化学方程式: 。每生成1molO2,转移的电子数为 mol。
A~H以及X、Y的转化关系如图: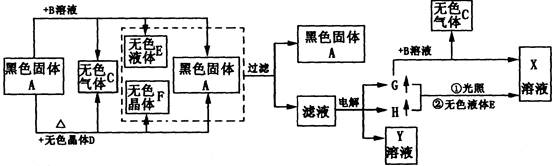
(1)电解上述滤液时产生G的电极是。其电极反应式为。
(2)取上图中滤液做焰色反应显紫色,上图中焰色反应显紫色的还有。
(3)写出黑色固体与X浓溶液共热反应的离子方程式。
(4)写出G与B溶液反应的化方程式。
有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Z2的电子式为,Y的原子结构示意图为,YW2的结构式为。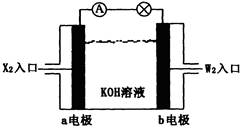
(2)将X2、W2按上图所示通入某燃料电池中,其中,b电极的电极反应式为。若有16gW2参加反应,转移的电子数是NA。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为。
图中硬质试管A中放入干燥洁净的细铜丝,左方烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水。
向B中不断鼓入空气,使甲醇蒸发和空气通过加热到红热程度的铜丝。
(1)为什么撤去A处酒精灯后铜丝仍然能保持红热?
(2)反应后将试管C中的液体冷却,取出少量,倒入新制的Cu(OH)2悬浊液,加热到沸腾可观察到什么现象?写出化学反应方程式。