一定温度和一定体积的密闭容器中发生如下反应:A2(s)+ B2(g) 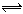 2AB(g) ,反应达到平衡状态的标志是
2AB(g) ,反应达到平衡状态的标志是
A.V正(B2)==2V逆(AB) B.单位时间内生成2molAB的同时消耗1mol的B2
C.容器内的总压强不随时间而变化 D.气体密度不再随时间变化而变化
铬(Cr)属于重金属元素,含铬的废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第______周期。
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。已知: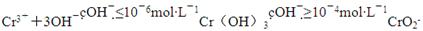
①FeSO4还原Cr2O72-的离子方程式为______________________________________________。
②Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为_____________________。
③沉淀法分离废水中的Cr3+,pH应控制的范围是________。
④下列关于铬及其化合物的说法中正确的是________。
A.K2Cr2O7是一种常用的强氧化剂
B.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
C.金属铬硬度大、耐腐蚀,是常用的镀层金属
24 mL浓度为0.05 mol·L-1的Na2SO3溶液(已知硫元素最高价为+6价),恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7(Cr元素最高价为+6价)溶液完全反应,则元素Cr在被还原的产物中的化合价是( )。
| A.+6 | B.+3 | C.+2 | D.0 |
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2
 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。
| A.方框中的物质应为CuS |
| B.该反应的部分产物可用于硫酸工业 |
| C.反应中SO2既是氧化产物又是还原产物 |
| D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
常温下,下列分子或离子在指定的分散系中能大量共存的一组是( )。
| A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- |
B. =0.1 mol·L-1的溶液:Na+、Cu2+、HCO3-、NO3- =0.1 mol·L-1的溶液:Na+、Cu2+、HCO3-、NO3- |
| C.空气:CH4、CO2、SO2、NO2 |
| D.0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、SO42- |
能正确表示下列反应的离子方程式是( )。
A.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |