下列说法正确的是
A.按系统命名法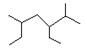 的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 |
| B.氨基酸常温下为固体,其熔点高的主要原因是分子间存在氢键 |
| C.某烃完全燃烧时产生的n(H2O)>n(CO2),是其肯定属于烷烃 |
| D.取等质量的乙烯和聚丙烯分别燃烧,它们的耗氧量不相同 |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是
| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓ |
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
| A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA |
| B.该混盐的水溶液显碱性 |
| C.该混盐中氯元素的化合价为+1和-1价 |
| D.该混盐具有较强的还原性 |
工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH33L恰好反应完全,则混合气中NO与NO2的体积分数比
| A.l:4 | B.1:3 | C.l:2 | D.l:l |
下列说法不正确的是
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同
| A.③④⑦⑧ | B.①③④⑦⑧ | C.①②⑤⑥⑨ | D.①④⑦⑨ |
以下反应可以类推的是
①由2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl类推
2FeCl3 + 3Na2S + 6H2O = 2Fe(OH)3↓ + 3H2S↑ + 6NaCl
②由Ca(HCO3)2 +2NaOH(过量) = CaCO3↓+ Na2CO3+ 2H2O类推
Mg (HCO3)2 +2NaOH(过量) = MgCO3↓+ Na2CO3+ 2H2O
③由NH4Cl  NH3 + HCl类推NH4NO3
NH3 + HCl类推NH4NO3  NH3 + HNO3
NH3 + HNO3
④由Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO类推
2C6H5ONa + CO2 + H2O =Na2CO3↓ + 2C6H5OH
| A.②和③ | B.仅有③ | C.仅有④ | D.以上都错 |