下面有关晶体的叙述中,错误的是
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围紧邻且等距离的Cl-构成的空间结构为立方体 |
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
反应PCl5(g) PCl 3(g)+Cl2(g) ①
PCl 3(g)+Cl2(g) ①
2HI(g) H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g) N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 |
| C.①增大,②不变,③减少 | D.①减少,②不变,③增大 |
在一密闭容器中进行以下可逆反应:M(g)+N(g)
 P(g)+2L在不同的条件下P的百分含量P%的变化情况如下图,则该反应
P(g)+2L在不同的条件下P的百分含量P%的变化情况如下图,则该反应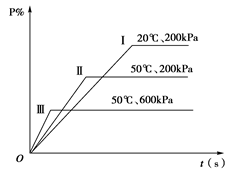
| A.正反应放热,L是固体 |
| B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 |
| D.正反应放热,L是固体或气体 |
恒温下在密闭容器中进行的反应2SO2 + O2 2SO3 达到平衡状态的标志是
2SO3 达到平衡状态的标志是
| A.容器中SO2、O2、SO3共存 |
| B.容器中SO2和SO3 浓度相同 |
| C.容器中n(SO2)∶n(O2)∶n(SO3)=2∶1∶2 |
| D.容器中压强不随时间而改变 |
氨水中有下列平衡 NH3·H2O NH4++OH—,当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
NH4++OH—,当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
| A.加NaOH | B.加HCl | C.加NH4Cl | D.加同浓度的氨水 |
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
| A.HI的生成速率等于其分解速率 |
| B.HI的生成速率小于其分解速率 |
| C.HI的生成速率大于其分解速率 |
| D.无法判断HI的生成速率和分解速率的相对大小 |