亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图所示
下列有关叙述正确的是
| A.亮菌甲素分子式为C12H11O5 |
| B.亮菌甲素能与三氯化铁溶液发生显色反应,1mol最多能与5molH2发生加成反应 |
| C.1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2mol NaOH |
| D.每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
阿伏加德罗常数约为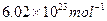 。下列叙述中正确的是
。下列叙述中正确的是
A.将含有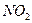 和 和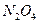 分子共约 分子共约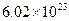 个的混合气体的温度降至标准状况,其体积约为22.4L。 个的混合气体的温度降至标准状况,其体积约为22.4L。 |
B.7.8g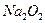 与足量水充分反应后转移电子数约为 与足量水充分反应后转移电子数约为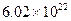 个 个 |
C.0.05mol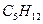 分子中所含共价键数约为 分子中所含共价键数约为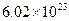 |
D.标准状况下,lmol 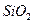 晶体中含有共价键数约为 晶体中含有共价键数约为 |
铝已被世界卫生组织确定为食品污染源之一,要求加以控制使用。铝在下列应用中应该加以控制使用的是
①制铝合金②制电线③制炊具④用明矾净水⑤制易拉罐⑥油漆颜料
⑦明矾与苏打制食品膨化剂⑧用氢氧化铝凝胶制胃舒平药片⑨包装糖果和小食品
| A.⑤⑦⑧⑨ | B.①②⑥ |
| C.④⑦⑧ | D.③④⑤⑦⑧⑨ |
下列关于盐酸与醋酸两种稀溶液的说法正确的是()
| A. |
相同浓度的两溶液中 相同 |
| B. |
100 0.1 的两溶液能中和等物质的量的氢氧化钠 |
| C. |
=3的两溶液稀释100倍, 都为5 |
| D. |
两溶液中分别加人少量对应的钠盐, 均明显减小 |
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是()
CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是()
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1mol.L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
pH相同的盐酸和醋酸两种溶液中,它们的()
| A.H+的物质的量相同 | B.物质的量浓度相同 |
| C.H+的物质的量浓度不同 | D.H+的物质的量浓度相同 |