设NA为阿伏伽德罗常数的数值。下列说法正确的是()
| A. | 1mol甲苯含有6 个 键 |
| B. | 18g 含有10 个质子 |
| C. | 标准状况下,22.4L氨水含有 个 分子 |
| D. | 56g铁片投入足量浓硫酸中生成 个 分子 |
下图表示水中c(H+)和c(OH-)的关系,
下列判断错误的是
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.XZ线上任意点均有pH=7 |
| C.图中T1<T2 |
| D.M区域内任意点均有c(H+)<c(OH-) |
某温度下,在一容积固定的容器中,反应aA(g)+bB(g) hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动B.混合气体的密度不变
C.B的体积分数减少 D.amol/L<c(A)<2amol/L
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是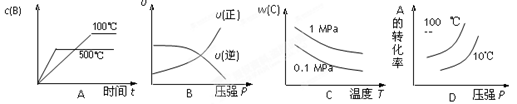
铁镍蓄电池其化学反应原理为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH) 2下列有关该电
Fe(OH)2+2Ni(OH) 2下列有关该电
池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热ΔH = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g),ΔH = -890.3 kJ/mol |
B.一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH = -38.6 kJ/mol 2NH3(g) ΔH = -38.6 kJ/mol |
| C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH = -571.6 kJ/mol |
| D.HCl和NaOH反应的中和热ΔH = -57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH = 2×(-57.3)kJ/mol |