溶液滴定盐酸实验中,不必用到的是
| A. | 酚酞 | B. | 圆底烧瓶 | C. | 锥形瓶 | D. | 碱式滴定管 |
电解法是处理工业废水的一种重要方法。如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理。电解时采用Fe作阳极,惰性电极作阴极。已知:①氧化性:Cr2O72->Fe3+;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31。下列说法正确的是
| A.阳极材料也可以是Cu |
| B.阴极每产生3molH2,则有1mol Cr2O72-被还原 |
| C.一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| D.电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
右图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
| A.分子组成为Cm(H2O)n的物质一定是糖类 |
| B.微生物所在电极区放电时发生还原反应 |
| C.放电过程中,H+从正极区移向负极区 |
| D.正极反应式为:MnO2+4H++2e—=Mn2++2H2O |
X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是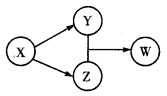
| A |
B |
C |
D |
|
| X |
HCl |
Na2O2 |
Na2CO3 |
SO2 |
| Y |
FeCl2 |
NaOH |
CO2 |
Na2SO3 |
| Z |
Cl2 |
Na2CO3 |
Ca2CO3 |
H2SO4 |
| W |
FeCl3 |
NaHCO3 |
Ca(HCO3)2 |
NaHSO3 |
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是:
| A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| B.Y的氢化物比R的氢化物稳定,熔沸点高 |
| C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z |
| D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。 |
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别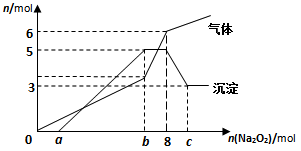
| A.2 mol、3 mol、6 mol | B.3 mol、2 mol、6mol |
| C.2 mol、3 mol、4 mol | D.3 mol、2 mol、2 mol |