I图示为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A.分子中含有三种含氧官能团
B.1 该化合物最多能与6反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与发生显色反应,也能和反应放出
Ⅱl,6-己二酸()是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备。下图为通过氧化反应制备的反应过程(可能的反应中间物质为、、、和):
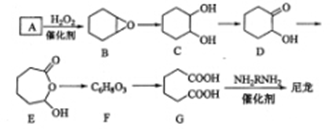
回答下列问题:
(1)化合物中含碳87.8%,其余为氢,的化学名称为
(2)到的反应类型为
(3)的结构简式为
(4)在上述中间物质中,核磁共振氢谱出峰最多的是
(5)由合成尼龙的化学方程式为
(6)由通过两步反应制备1,3-环己二烯的合成路线为
用于分离或提纯物质的方法有:
| A.蒸馏(分馏) | B.萃取 | C.过滤 | D.重结晶 E.分液。 |
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙(2)分离四氯化碳与水的混合物
(3)分离汽油和煤油(4)分离碘水中的碘单质
(5)KNO3晶体中含有少量食盐。
下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合学过的化学知识,回答下列问题:
| 配料表 |
精制海盐、碘酸钾(KIO3) |
| 含碘量 |
20―40mg/kg |
| 储藏方法 |
密封避光、防潮 |
| 食用方法 |
烹调时待食品熟后加入碘盐 |
据物质分类中的树状分类法有关知识,在① HIO3② 碘酸钠 ③ KOH ④ I2O5 ⑤ NaCl五种均属于(填“混合物”或“化合物”或“盐”或“氧化物”),其中与碘酸钾(KIO3)属于同类物质的有 _________(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时。
请用物质的组号填写下表。
| 类型 |
同位素 |
同素异形体 |
同分异构体 |
同系物 |
| 组号 |
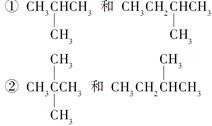
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3
⑦臭氧(O3)和氧气(O2)
将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,此溶液50mL正好与50mL0.4mol/L的AgNO3溶液完全作用。由上述数据可知4.06g的MgCl2·xH2O物质的量是_______mol,式中x的数值是_____。
现有下列十种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤蔗糖晶体 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-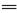 H2O,该反应的化学方程式为。
H2O,该反应的化学方程式为。
(2)⑩在水中的电离方程式为,
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:
(4)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式。