短周期主族元素、、、的原子序数依次增大。原子的最外层电子数是其内层电子数的2倍,是地壳中含量最高的元素,
2+与2-具有相同的电子层结构,与同主族。下列说法正确的是()
| A. | 原子半径大小顺序: |
| B. | 分别与 , 形成的化合物中化学键类型相同 |
| C. | 的最高价氧化物对应水化物的酸性比 的弱 |
| D. | 的气态简单氢化物的热稳定性比 的强 |
下列反应中,Na2O2只表现强氧化性的是
| A.2Na2O2 + 2CO2 |
| B.Na2O2 + MnO2 =Na2MnO4 |
| C.5Na2O2 + 2MnO + 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O |
| D.2Na2O2 + 2H2SO4 = 2Na2SO4 +2H2O + O2↑ |
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
| A.平衡正移 | B.(a+b)>(c+d) |
| C.Z的体积分数变小 | D.X的转化率变大 |
将4体积的H2和1体积的O2混合,4 g这种混合气体在标准状况下所占的体积是
| A.5.6 L | B.11.2 L | C.22.4 L | D.33.6 L |
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol—1、P—O b kJ·mol—1、P="O" c kJ·mol—1、O="O" d kJ·mol—1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是: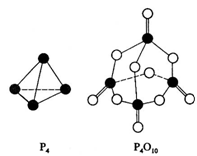
| A.(4a+5d-4c-12b)kJ·mol—1 |
| B.(4c+12b-4a-5d)kJ·mol—1 |
| C.(4c+12b-6a-5d)kJ·mol—1 |
| D.(6a+5d-4c-12b)kJ·mol—1 |
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器接触室(见下图)。按此密闭体系中气体的流向,则在A处流出的气体为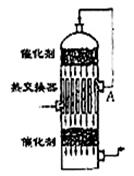
| A.SO2 |
| B.SO3、O2 |
| C.SO2、SO3 |
| D.SO2、O2 |