污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的,又制得电池材料(反应条件已略去)。
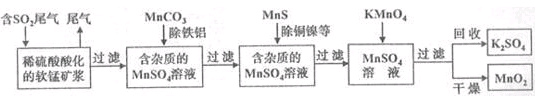
请回答下列问题:
(1)上述流程脱硫实现了
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用能除去溶液中和,其原因是
(3)已知:25℃、101时,
与反应生成无水的热化学方程式是
(4)可作超级电容器材料。用惰性电极电解溶液可制得,其阳极的电极反应式是
(5)是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是
(6)假设脱除的只与软锰矿浆中的反应。按照图示流程,将(标准状况)含的体积分数为%的尾气通入矿浆,若的脱除率为89.6%,最终得到的质量为,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于
(实验班)(15分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO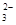 (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________________,该反应的平衡常数为_________________(填具体数字);该反应能发生的原因是
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO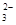 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;②增大CO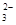 的浓度,平衡常数K将________。
的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为_________________________________________________________。
(普通班)(15分)已知常温下,AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17.
(1)AgBr固体在水中达到溶解平衡,写出其表达式;此时溶液中c(Ag+)=mol/L;
(2)现向AgBr的悬浊液中:①加入AgNO3固体,则c(Br -)(填“变大”、“变小”或“不变”,下同);②若改加更多的AgBr固体,则c(Ag+);
③若改加更多的KI固体,则c(Ag+),c(Br -)。
(3)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是()
| A.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
(实验班)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+)0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) −c (M+)= mol·L-1,c (H+) −c (MOH) = mol·L-1。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度(填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH 7(填“>、<或=”)。
(普通班)(13分)(1)常温下, CH3COONa溶液呈 性,用离子方程式解释其原因。
(2)室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。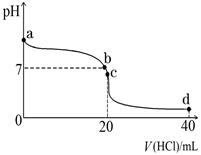
①NH3·H2O的电离方程式是。
②b点所示溶液中的溶质是。
③c点所示溶液中,离子浓度从大到小的关系为,在该溶液中存在多种守恒关系,其中c(NH4+)+c(H+)=(用离子浓度表示)。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题: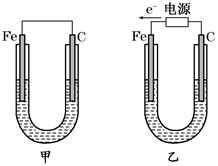
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:__________________________________。
②甲装置中碳极的电极反应式是___________ _______,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:
_______________________________________________________________________。