乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯()。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①△H1=-23.9KJ·mol-1
甲醇制烯烃反应② △H2=-29.1KJ·mol-1
乙醇异构化反应③ △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应的△H=
与间接水合法相比,气相直接水合法的优点是:
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中=1︰1)

①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=
②图中压强P1、P2、P3、P4的大小顺序为:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:
镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是镁原子电子式
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是(不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg > Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④通过观察某种实验现象得到结论,该实验现象是
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。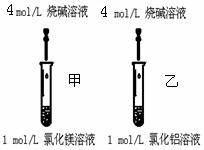
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg > Al”
甲试管现象
乙试管离子方程式
实验三:利用原电池原理也可得出“金属性:Mg > Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg >Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
化学世界奥妙无穷,物质之间的反应更是神秘莫测,善于透过现象看本质是学习化学、研究物质性质的基本能力。请我们一起进行探索。
(1)课堂上化学老师将干燥的氯气依次通过干燥红布条和潮湿的红布条,结果:干燥红布条无明显变化,而潮湿的红布条褪色。
①某学生立即发言:结论一、,
结论二、氯气与水反应生成的次氯酸具有漂白性。
②老师提示说:还需要补充一个实验才能得知结论二,该实验是
③请写出氯气与水反应的离子方程式
(2)某实验小组用铜和浓硝酸反应制备NO2,并收集一试管NO2气体,将集气瓶倒置于水槽中,并轻微振荡,发现一些典型现象,并对此现象进行探究。
①请写出NO2与水反应化学方程式,并用单线桥表示电子转移方向和数目
②该小组成员积极探讨,得出结论,NO2与水一定发生了化学反应,并设计了两个实验操作对产物进行了验证,得出产物是NO 和HNO3。请填写下表中的甲、乙、丙三处。
| 实验操作 |
实验现象 |
实验结论 |
| 用玻璃片将水槽中的试管口盖住,轻轻将试管取出 |
试管内约有2/3体积的水溶液,且无色 |
NO2与水发生了化学反应,而不是溶于水 |
| 将试管正立,取下玻璃片 |
甲 |
NO2和水反应生成了NO气体 |
| 乙 |
丙 |
NO2和水反应生成了硝酸 |
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯有关性质如下:
| 分子式 |
别名 |
熔点 |
沸点 |
溶解性 |
性状 |
| ClNO |
氯化亚硝酰 |
-64.5℃ |
-5.5℃ |
溶于浓硫酸 |
红褐色液体或有毒气体,具有刺激恶臭,遇水反应生成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯性质拟在通风橱中制取亚硝酰氯,设计了如图所示实验装置。实验开始前K2处于打开状态,K1、K3均已关闭。、
试回答下列问题:
(1)①若D中装有纯净的NO气体,则B中应选用的试剂为。实验时利用B除去某些杂质气体并通过观察B中的气泡来判断反应速率,B还具有的作用是;②若D中装有纯净的氯气,则C中应选用的试剂为。
(2)装置F的作用是;装置G的作用是。
(3)若无装置G,则F中ClNO可能发生反应的化学方程式为。
(4)某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO,所以装置H不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
阅读下列文字,填写文中带圈的数字后面的空白:
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:①;
原因Ⅲ:Cl-对反应具有促进作用,而 SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③,实验2中④,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(三)为了使实验“定量化”、使结果更精确,可以对实验进行如下改进:
1.配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用⑤(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为⑥。配制溶液时还需要用到的玻璃仪器有⑦、烧杯、胶头滴管和量筒等。
2.比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?⑧(要求回答一种即可)。
实验室用如图所示的装置制取乙酸乙酯.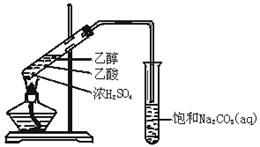
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是。
(3)浓硫酸的作用是①;②.
(4)饱和Na2CO3溶液的作用是。
(5)乙酸乙酯的密度比水(填“大”或“小”),有味.
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是
(填物质名称).