(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 _______。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 __(填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:
①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是 、 。
(4)写出沉淀反应中的离子方程式: 。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 (25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
酸、碱、盐在水溶液中发生的复分解反应,实质上就是两种电解质在溶液中
的反应,这类离子反应发生的条件是 、 、或 。
用4mol/L的标准盐酸配制0.1mol/L的盐酸500mL,需要的主要仪器有: 、 、 、 、 。
测血钙的含量时,可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 mol/L。
下图是一个化学过程的示意图。
(1)通入O2的电极名称 、C(Pt)电极的名称是______________
(2)写出通入O2的电极上的电极反应式是_______ _______________________。
(3)写出通入CH3OH的电极上的电极反应式是______________________________。
(4)乙池中反应的化学方程式为__________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2__________mL(标准状况下);
根据如图所示装置回答: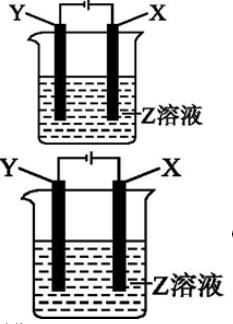
(1)当X为Pt, Y为Fe, Z为AgNO3时,阳极反应为 ,阴极反应为
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
(3)用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为 mol/L