已知:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H="-1" 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H="-1" 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )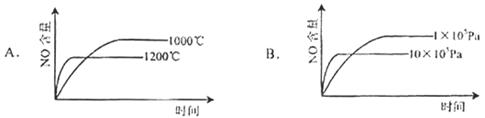
下列有关物质的性质与应用不相对应的是
| A.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
下列用品的有效成分及用途对应错误的是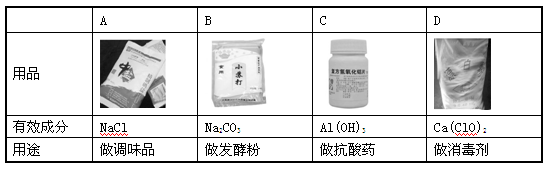
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转化技术;
④田间焚烧秸秆;⑤推广使用节能环保材料。
| A.①③⑤ | B.②③⑤ | C.①②④ | D.②④⑤ |
一定量的锌与100 mL 18.0mol·L-1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6 L。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。则下列说法中错误的是
| A.生成的气体中SO2的物质的量为0.3mol |
| B.生成的气体中SO2的物质的量为0.25mol |
| C.溶解Zn的物质的量为1.5mol |
| D.反应中转移电子的物质的量为3mol |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.344L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 6mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60mL | B.40mL | C.30mL | D.15mL |