Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: 。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
请回答:
(1)图中各装置接口连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略,): → → →⑥ → ⑦ → → →
(2)装置C中放入的反应物是 和 (填化学式)。
(3)装置B的作用是 。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意__a___和 (填字母编号)。
| A.视线与凹液面最低处相平 | B.等待气体恢复常温才读数 |
| C.读数时应上下移动乙管,使甲乙两管液面相平 | D.读数时不一定使甲乙两管液面相平 |
(5)实验测得收集的氧气在标准状况下体积为V L,则参与反应的Na2O2的物质的量为 mol。
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为: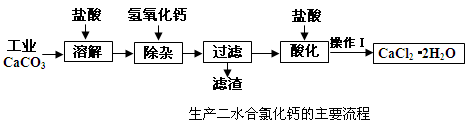
(1)CaCO3与盐酸反应的离子方程式。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:①,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括、、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操作 |
现象 |
通入氯气至过量 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是。
(2)A中溶液变红的原因是。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为 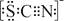 。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是。
③通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是mol。
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图: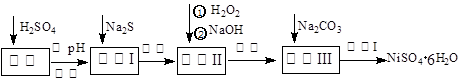
请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10−39)。下列说法正确的是______(选填序号)。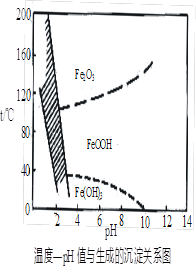
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol•L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②__________________________________;
③;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: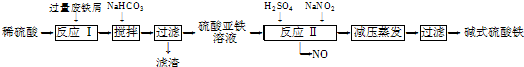
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的___________(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是___________________.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作______。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)聚合离子。该水解反应的离子方程式为____________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
中国医学博大精深,很多化学物质很早就出现在了我国著名的医书中。如我们黄冈人李时珍的《本草纲目》中就有记载“绿矾(FeSO4·7H2O)又名皂矾,主要药用功能是除湿、解毒、收敛、止血”。某化学兴趣小组为测定某绿矾产品中FeSO4·7H2O的质量分数,设计了如下实验:
Ⅰ、在电子天平上称取2.850g绿矾产品,溶解配制成250 mL溶液;
Ⅱ、取25.00 mL该溶液于锥形瓶中;
Ⅲ、用硫酸酸化的0.010 mol/L KMnO4溶液滴定至终点,滴定结束后消耗KMnO4溶液体积的平均值为20.00 mL。请回答下列问题:
(1)步骤Ⅰ中配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯外,还需要、。
(2)滴定时盛放KMnO4溶液的仪器是。(填仪器名称)
(3)若在滴定终点读取滴定管刻度时,仰视KMnO4溶液液面,其他操作均正确,则最后测定的FeSO4·7H2O质量分数。(填“偏高”、“偏低”或“无影响”)
(4)关于滴定操作的下列说法中正确的是。
| A.该滴定实验可以用KSCN溶液做指示剂 |
| B.滴定前,滴定管及锥形瓶均要用待盛装的溶液润洗 |
| C.滴定时,眼睛应注视着滴定管液面的变化 |
| D.滴定时应先快后慢,当接近终点时,应一滴一摇 |
E.当滴入最后一滴标准液后,锥形瓶内溶液颜色发生明显变化,应立即读数
F.数据处理时,若某次滴定所消耗的溶液体积与其他几次相差太大,应舍去
(5)经计算,上述样品中FeSO4·7H2O的质量分数为。(结果保留三位有效数字)