下列关于溶液中离子的说法正确的是
| A.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)="2c" (CO32-)+c (HCO3-)+c (H2CO3) |
| B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系: c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系: c(Na+)=c(CH3COO-) |
| D.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (OH-)="c" (H+)-c (S2-)+c (H2S) |
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
| A.在300 ℃条件下,t1时刻该反应达到化学平衡 |
| B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L |
| C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小 |
| D.由图像说明该反应的正反应为放热反应 |
在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(气)+2B(气)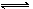 xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
A.x=3 y=1 B.x=4 y="1" C.x=5 y =1 D.x=8 y=2
可逆反应:A2(?)+B2(?)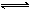 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是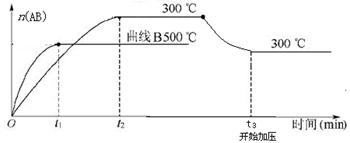
A. A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
如图是表示:2X+Y 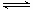 Z+R⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
Z+R⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是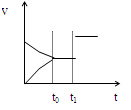
| A.减少Z物质 | B.加大压强 | C.升高温度 | D.使用催化剂 |
将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
| A.11.5倍 | B.5.75倍 | C.23倍 | D.30.67倍 |